- 收藏
- 加入书签
高中化学课堂氢氧化钠亚铁的制备方法的改进
氢氧化亚铁是铁的无机化合物,化学式为Fe(OH)2 。从物理特性来看,氢氧化亚铁是白色固体,极微溶于水,密度为3.4g/cm 。从化学的角度来看,氢氧化亚铁很容易受热分解,为中强碱,在酸中可溶,在碱中难溶,而且非常容易被氧化。一般情况下,可以用亚铁溶液和强碱溶液相互反应制取氢氧化亚铁。氢氧化亚铁本身极不稳定,在工业上和生活中具有着较为广泛的应用,一般有着以下几个方面的用途:(1)可以用氢氧化亚铁所制得的胶体来净水;(2)可以用于氢氧化铁的制备;(2)可以用于还原水和硝酸;(4)可以用作原料的制备,药物的提取,在必要的条件下,可以用作催化剂等。
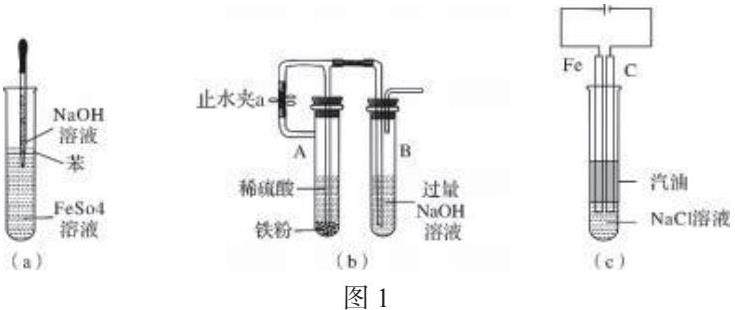
人教版高中化学必修 1 教材中将 FeSO4 溶液加 入到 NaOH溶液中制备氢氧化亚铁 ,观察到生成的 白色絮状沉 淀 迅 速 变 成 灰 绿 色 , 最 后 变 成 红 褐 色 . 实验中通常都会出现灰绿色 ,很难观察到白色沉淀 , 不少学者对该过程开展了研究 ,提出了如下几种观 点 :①FeSO4 溶液中含有 Fe3+ 对实验有影响 ; ②溶液中溶解氧使得形成的沉淀是Fe(OH)2 、Fe(OH)3 等的混合物及其水合物 ; ③Fe(OH)2 沉淀吸附了过量的Fe2+而使沉淀变成灰绿色 .鉴于以上观点 ,有如图1 所示的几种常见实验改进装置 . (a) 图采用油封及长滴管滴加液体法, (b)图采用在还原性氛围中制备法(c)图采用油封铁做阳极电解法等 . 但实验时(a) 图观察到白色 沉淀的时间较短 ,甚至有时观察不到白色沉淀 , (b) 图对装置气密性的要求较高, (b)(c) 图装置略显复杂 ,课堂演示时间较长 ,学生分组实验操作较难 .
在此分析的基础上提出以下适合高中课堂上制备氢氧化亚铁的改进:
1.实验用品
药品 :还原铁粉(分析纯) 、硫酸(分析纯) 、氢氧化钠(分析纯) .
仪器 :锥形瓶 、试管 、长胶头滴管 、扎有小孔的气球
2.实验过程
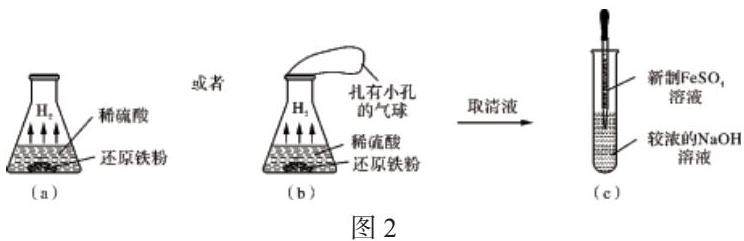
(1) 新制 FeSO4 溶液:在洁净的锥形瓶中加入足量还原铁粉(分析纯) ,再加入适量用硫酸(分析纯度)配制的稀溶液 ,将锥形瓶口用扎有小孔的气球套紧 ,也可以不使用气球 , 如 图 2 (a) (b)所示, 静置 5~12 h待用(可在实验前一天配制) .
(2) 配制较浓的NaOH溶液 : 将氢氧化钠 (分析纯度)溶于蒸馏水配制较浓的 NaOH 溶液待用 , 蒸馏水和较浓 NaOH 溶液可不用加热煮沸 处理 .
(3) 实验操作:捏紧长胶头滴管的胶头,赶出其中空气,用其吸取一定量的新制 FeSO4溶液中的清液 ,然后将滴管插入过量较浓的NaOH溶液的液面下,如图2(c)所示 , 挤压胶头滴管,滴加 FeSO4 溶液即可 .
3.实验现象
产生白色沉淀,白色沉淀持续时间为 5~10 min 左右 .振荡试管 ,可观察到白色沉淀变成灰绿色 ,最后变成红褐色 .
4.该实验设计的优点
(1) 药品、仪器的使用符合中学化学实验室的要求 .还原铁粉 、硫酸 、氢氧化钠、锥形瓶、长胶头滴管等器材中学实验室中都有,不需要特殊药品和仪器,并且试剂用量较少,节约药品 ,尤其是 FeSO4 溶液每次实验只需要几滴,便于开展学生分组实验 .
(2)FeSO4溶液可在实验课前5~12 h配制,NaOH溶液可在实验课前几分钟配制, 二者反 应时灵敏迅速,可节约教师课堂演示实验或学生分组实验的时间 .
(3)锥形瓶口径小,与空气接触面积小,加之里面有氢气不断溢出,减少了空气的进 入 , 使得体系内的溶解氧达到最小程度.锥形瓶瓶口用扎有小孔的气球套紧,也可一步减少空气的进入.另外,将长胶头滴管插入较浓的NaOH溶液的液面下滴加 FeSO4 溶液 ,这样操作可减少滴加试剂过程中氧气的再溶入 .
(4)采用过量还原铁粉与稀硫酸新制备 FeSO4 溶液 ,保证体系内几乎无 Fe3+ 存在 ,排除其对实验的干扰 .
(5) 将少量新制 FeSO4 溶液滴加到过量的较浓的NaOH溶液中(与人教版高中化学必 修1教材实验顺序相反) ,保证Fe2 + 充分反应,避免 Fe(OH) 2 沉淀吸附 Fe2+等有色离子 ,排除其对实验现象的干扰 .





 京公网安备 11011302003690号
京公网安备 11011302003690号

