- 收藏
- 加入书签
基于一种包含内源质控的三重实时荧光PCR同步检测肉及肉制品中牛和牦牛源性的方法研究
摘要:本研究以食品中不同肉类成分为样本进行测试,实验采用的方法是将引物与探针引入到DNA中的cytb基因保守区里,用此创建PCR检测方法来对食品中的牛-牦牛源性成分进行实时检测,具体操作就是利用这种方法对引物与探针的灵敏度进行检测。结果表明,该DNA扩增片段序列为123 bp,最低能分别检测到0.0025 ng/μL和0.025 ng/μL的牛和牦牛肉 DNA ,表明所用的引物和探针具有良好的特异性和灵敏度,说明这中检测方法的使用是值得推荐的,其特点主要体现在高效、便捷与高灵敏,可以有效的检测食品中的牛源性成分。
关键词:牛-牦牛源性成分;实时荧光 PCR 技术;特异性;灵敏度
中图分类号:G4 文献标识码:A
前言
随着人们生活水平逐渐变好,人们消费水平也在不断提高,对肉类的需求不断增强[1]。与此同时,食品安全问题备受社会关注,一直是大众的焦点[2, 3],所以人们对动物肉的安全和质量也变得更加注重。近年来,不法商家将价格低廉的肉混入价格昂贵的肉中进行售卖的新闻屡见不鲜,有关肉类食品安全性问题的报道更是数不胜数。2014年食品安全事件造成了巨大的经济损失和重大安全隐患,给肉类市场造成巨大的冲击,因而消费者对于肉类食品安全格外重视[4-7]。这不仅涉及市场经济问题,也危害了消费者的安全,尤其是对食物成分敏感的消费者。因此,为了保护消费者的合法权益和安全健康,减少掺假食品对人们造成健康损害,对食品中动物源成分进行检测显得尤为重要。鉴于食品种类众多、成分多样且复杂和加工工序繁琐(多为深加工),目前的检测方法难以达到理想效果,包括免疫检测、物理方法和基于分子。如高效色谱法,酶吸附法,光谱检测法,巢氏 PCR 法以及多重 PCR 检测方法等[7-9]。这些检测方法中存在明显的缺陷,对食物检测灵敏度较低,周期长,且费时费力。
目前,应当建立一种快速有效的检测方法对食品中动物源性成分进行检测,便于食品监管部门等能够在第一时间迅速检测出食品中的动物源性成分[11,12]。由于PCR技术具有高效、快捷和灵敏度高的特点,所以本文决定采用此技术。检测方法主要是利用DNA中cytb基因中的引物与探针进行检测的,目的是可以对食品中是否存在牛源性成分进行实时检测。
1 材料与方法
1.1 材料与试剂
各类市场加工肉制品,包括:驴肉,牛肉,鸡肉,鸭肉,鱼肉,猪肉,绵羊肉,兔肉,山羊肉等各类动物样品,均是购买于吉林市地方菜市场或大型生鲜超市,均为整块肉。
荧光定量PCR MasterMix(SYBR Green),PCR 预混液,DNA 分子量标准 Marker A (25-500 bp),异丙醇,无水乙醇,冰乙酸,琼脂糖,蛋白酶K 溶液(20 mg/mL),EP 管,荧光定量 PCR 反应板均购自上海市生工生物工程有限公司。CTAB 提取缓冲液(pH8.0 ),CTAB 沉淀液,10% SDS 溶液(十二烷基硫酸钠),硼酸,Tris-base,乙二胺四乙酸二钠(EDTA)均国药集团-化学试剂有限公司。密封袋,移液枪及其配套枪头。
1.2 仪器与设备
电子天平(DP225F 防爆型,上海菁海仪器有限公司);PCR扩增仪与分子凝胶成像系统(美国 BIO-RAD企业);普通实验室用电泳仪(DYY-6C 型,北京市六一厂);恒温水浴锅(常州市智博瑞仪器制造股份有限公司);高速台式离心机(5418R,德国Eppendorf AG公司);核酸蛋白测定仪(Nanodrop 2000c,美国Thermo Fisher公司);实时荧光PCR扩增仪(7300plus,美国ABI公司)。
1.3 实验方法
1.3.1 样品制备
将1.1中所述动物材料样品用冷冻研磨机碾磨成粉末状,烘干机温度设置为65 °C,烘干粉末状动物样品(3~4 h),分别配置成含有不同质量分数的肉粉混合样品,并将其分别置于密封袋内室温保存。
1.3.2 提取DNA
本实验主要用 CTAB 法提取样品 DNA,具体操作步骤如下:将不同种类的动物样品磨成粉末后,取样品0.1 g 而后置于1.5 mL 灭菌 EP 管中,将pH8.0 的CTAB(900 μL)与SDS(10%)混合加入到容器中进行混匀处理;此时再倒入蛋白酶溶液(20 μL)同样混匀;将最终的混合用65 °C连续水温浴2~3h进行裂解,每隔30 min 进行混匀;裂解完后,室温冷却5 min,室温下离心10 min(2000 r/min),重复上一步;加入70%乙醇混匀,在室温的环境下进行离心处理(2000 r/min),处理时间为10min;然后放置约5 min,然后将上清液取出放入到1.5 mL 灭菌管中;将异丙醇(500 μL)倒入溶液中混匀,室温静置20 min,13000 r/min离心10 min,弃去上清液于废液收集桶;向 EP 管中加入50 μL TE buffer,65 °C 水浴5 min,取出EP管,获得基因组 DNA,将 DNA 放入冰箱-20 °C,待用。
Nanodrop 2000c核酸蛋白测定仪测定样品 DNA 的浓度和纯度,取DNA 样品 OD 260/OD 280 处的吸光度值在1.7~1.9之间的DNA 样品进行PCR实验。将样品DNA 溶液(100 ng/μL)进行稀释,分别为25 ng/μL,20 ng/μL,0.25 ng/μL,0.025 ng/μL和0.0025 ng/μL的 DNA 混合样品溶液,用于后续的样品检测。
1.3.3 探针以及引物设计
依据 Genbank 基因数据库所公布的牛和牦牛线粒体 DNA 的1号染色体基因序列,利用 DNAMAN 设计特异性引物和探针。引物及探针由北京市生工生物工程有限公司合成,引物和探针序列如表1。
1.3.4 实时荧光 PCR实验
建立三重实时荧光PCR反应体系,分别使用该体系进行物种特异性检测和牛-牦牛-质控的三重实时荧光PCR扩增反应。三重实时荧光 PCR 体系体系为20 μL:上游引物、下游引物各1 μL,DNA 模板2μL,PCR MIX 10 μL,三个探针分别0.5 μL,灭菌水4.5μL。PCR 反应条件为:94 °C:30 s,94 °C;5 s ,60 °C,31s,共40个循环。
1.3.5特异性检测及灵敏度评价
采用从牦牛肉、牛肉和其他非目标物种(驴肉、牛肉、鸡肉、鸭肉、鱼肉、绵羊肉、兔肉和山羊肉)中提取的DNA,确定三重实时荧光PCR检测的特异性。并用统计分析对鉴定结果进行分析。通过测定检测限(LOD)来评价该方法的灵敏度。采用稀释样品DNA计算LOD值。每种稀释使用20个重复,用统计分析确定灵敏度(置信区间:95%)。
2 结果
2.1 引物实用性验证
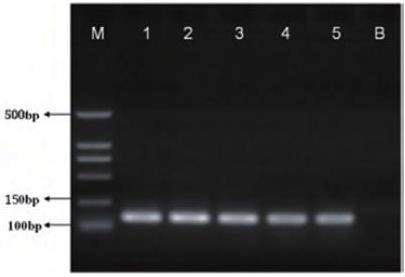
本研究为验证DNA的完整性,采用对各样本的DNA实施PCR扩增,并且设置了空白对照,待结束后,利用电泳检测试验分析其结果,其扩增结果可见图1所示。该样本中的基因尺寸为123bp,隐形样本(牛肉和牦牛肉样本)无目的片段,与试验预期结果一致,检测结果表明该引物对可以特异性检出食品中的牛源性成分。
2.2 三重实时荧光 PCR 特异性检测
本实验为了测试出引物与探针的特异性,牛特异性探针用FAM标记,牦牛特异性探针用HEX标记,内源性对照探针用ROX标记,进行实时荧光PCR的扩增,并将实验重复3次,该实验结果如图2。从结果可以看出,牛肉稳定扩增牛-FAM的扩增曲线,牦牛肉稳定扩增牦牛-HXE的扩增曲线,在扩增状态及内源质控-ROX的扩增足以验证三重实时荧光PCR技术有效控制假阴性结果。说明该引物探针特异性强,适用于肉中牛、牦牛源性成分三重实时荧光PCR检测。
2.3 三重实时荧光 PCR 灵敏度检测
将样品 DNA 用10倍倍数进行稀释,质量浓度分别为25 ng/μL、20 ng/μL、0.25 ng/μL、0.025 ng/μL和0.0025 ng/μL,之后要进行PCR扩增实验,实验反复进行三次,其扩增结果如图3所示。各质量浓度扩增均获得目的基因片段,其各扩增曲线趋势良好,且各试验重复性良好。其中牛肉在5种浓度之下都扩增,牦牛肉在质量浓度为25 ng/μL、20 ng/μL、0.25 ng/μL和0.025 ng/μL 样品检测出扩增曲线,且扩增曲线形状良好,而质量浓度为0.0025 ng/μL的样品未曾发现扩增曲线,表明其荧光信号未超过荧光阈值。可以看出该体系中牛肉和牦牛肉灵敏度分别为0.0025 ng/μL和0.025 ng/μL,其检测灵敏度较高。
2.4 样品检测结果
现今社会PCR技术已经普遍应用于各类食品检测中,但主要用于转基因的检测和检测食品中是否存在微生物,以提高食物的安全和卫生两个方面。本研究正是用此方法对吉林市采集的不同动物肉样品进行检测,在试验结果中可以明显的看出特异性明显只出现在牛肉样本中,且灵敏度在质量浓度大于0.025-0.0025 ng/μL时变现良好。从而得知,驴肉,鸡肉,鸭肉,鱼肉,猪肉,绵羊肉,兔肉等中皆未检测出牛和牦牛源性成分,而扩增曲线确实只出现在牛和牦牛肉中,其检验结果与食品成分相符合。说明使用三重实时荧光定量 PCR的方法进行牛和牦牛肉成分的检测可行。
3 讨论
目前,物理方法检测动物源性成分分析速率较快,但是需要对动物源成分的分析建立模型,且对动物成分分析缺乏足够证据,分析数据不精确,数据会随着成分的改变而发生变化[10]。光谱法检测动物源性成分,对蛋白稳定性及浓度和质量的要求比较高。由于蛋白受热容易分解,蛋白溶解度会随之降低,将会不利于检测食物中成分。近年来分子免疫检测方法发展迅速,其具有操作方便、省时、高效、结果准确[13]的优点。其中,实时荧光 PCR 技术是以目的核酸为模板设计特异性引物及探针,在封闭条件下进行扩增和检测,无需进行电泳检测,避免扩增产物对检测实验室产生巨大的污染,且检测时间短,可扩增较短片段,便于深加工的食品样本检测[14]。在科学研究和实践生产中都得到了广泛的应用,其中包括在基础生物学、环境检测、医学检测和诊断等方面,在动物源性食品方面也得到了一些应用,那么本研究就是采用了荧光定量PCR的方法。
国内学者用实时定光定量 PCR 方法检测食品中成分已取得众多成效。陈永锋[5]等对山羊和绵羊的源性成分进行双重PCR检测方法,进行扩增目的基因同时,检测对应成分,避免出现食品中假阳性。李家鹏等在食品和饲料中动物源性成分检测技术研究进展中,后期使用电泳结果进行检测时,发现该检测方法费时费力,而且效果不太明显。陈颖等在研究食品及饲料中牛属动物源性成分的 PCR 检测中,设计引物特异性良好,但是该方法费时费力,而且周期较长,试验效果不佳。
本试验主要是以食品中的牛-牦牛源性成分为研究对象,使用牛、牦牛的线粒体 DNA 的 cytb 基因进行特异性的引物和探针设计,并用实时荧光 PCR 方法对其进行特异性和灵敏度的检测,相比于传统的PCR技术,此方法减少了扩增后电泳的检测操作,其特异性良好,灵敏度最低检测限为0.025和0.0025 ng/μL牦牛和牛肉 DNA 样品,较之前的检测结果的灵敏度有所提高,但从图3中可看出其灵敏度结果并不是很理想,还是有待提高。
结论
在上述试验中,采用了PCR技术与别的方法进行对比发现,该技术的优势主要体现在较高特异性和灵敏度。该技术由于操作便捷、稳定性高、重复性好以及高效等特点,被广泛的应用于检测各种牛和牦牛加工产品(特别是深加工产品),因此在食品安全方面的检测中具有重要的作用,这是因为这项技术在食品检测中可以用于不同种类的食品检测,所以使用范围非常之广,并且有机会可以成为高效检测牛和牦牛源性成分的食品。本研究通过三重实时荧光PCR分析,建立了一种可检测食品中牛-牦牛源性成分的方法,该检测方法具有特异、灵敏、准确以及便捷的多种特点,可作为食品中牛-牦牛源性成分安全检测的有效手段。本文为检测食品中牛牦牛源性成分掺假的安全问题以及维护消费者权益提供了理论基础。
参考文献
[1] 刘娜, 杨滴, 韩东. 食品中鹅源性成分实时荧光 PCR 检测方法的建立[J]. 肉类工业,2016(10):37~39.
[2] 沙才华, 黄海超, 谢筱筱, 等. 食品中牛源性成分荧光 PCR 检测方法的建立[J]. 畜禽业,2016(08):56~58.
[3] 范丽丽, 李培, 傅春玲, 等. 食品中猪源性成分实时荧光 PCR 检测方法建立[C]. 中国营养学会(Chinese Nutrition Society).中国营养学会第十一次全国营养科学大会暨国际DRIs研讨会学术报告及论文摘要汇编(下册)——DRIs新进展:循证营养科学与实践学术.中国营养学会(Chinese Nutrition Society):中国营养学会,2013:335.
[4] 郭云霞, 张舒亚, 谌鸿超, 等. SYBR Green实时荧光 PCR 检测食品中鲨鱼源性成分真实性方法的建立[J]. 食品与生物技术学报,2012,31(12):1300~1306.
[5] 陈永锋. 饲料及动物性食品中山羊源性和绵羊源性成分双重荧光 PCR 检测方法的建立[J].福建畜牧兽医,2012,34(03):1~4
[6] Mane B G, Mendiratta S K, Tiwari A K, et al. Detection of adulteration of meat and meat products with buffalo meat employing polymerase chain reaction assay[J]. Food Analytical Methods,2012(5):296~300.
[7] Koppel R, Daniels M, Felderer N, et al. Multiplex real-time PCR for the detection and quantification of DNA from duck, goose, chicken, turkey and pork[J]. European Food Research and Technology, 2013, 236(6):1093~1098.
[8] GB/T 20190-2006饲料中牛羊源性成分的定性检测定性聚合酶链式反应(PCR)法.
[9] SN/T 2557-2010畜肉食品中牛成分定性检测方法实时荧光 PCR 法.
[10] SN/T 2051-2008食品,化妆品和饲料中牛羊猪源性成分检测方法实时 PCR 法.
[11] 杨宝华, 宗卉, 林庆燕, 等. 用分子生物学方法鉴别检测动物源性饲料中的牛羊源性成分. 中国畜牧兽医杂志, 2002(01):3~5.
[12] 冯秀燕, 董红霞, 魏秀莲, 等. 动物源性饲料中牛源和羊源性成分的检测方法. 饲料研究,2006(11):52~54.
[13] 刘登勇, 周光宏, 徐幸莲, 等. 我国肉鸡加工业的现状及发展趋势[J]. 食品科学, 2005, 26(11):266~269.
[14] 李家鹏, 乔晓玲, 田寒友, 等. 食品和饲料中动物源性成分检测技术研究进展[J]. 食品科学, 2011, 32(9): 340~347.
[15] 王玲, 姜辉, 田亚平, 等. 普通人群14种食物不耐受情况初步分析[J]. 军医进修学院学报, 2007,28(2):129~131.
[16] 陈颖,吴亚君, 徐宝梁, 等. 食品及饲料中牛属动物源性成分的 PCR 检测研究[J]. 中国生物工程杂志, 2004,24(5): 78~83.
[17] 王金玲, 贾金生, 李俊环, 等. 饲料中鸡源性成分 PCR-DHPLC 检测方法的建立[J]. 中国兽医学报, 2012, 32(3): 493~496.





 < a rel="example_group" title="Custom title" href="http://img.resource.qikan.cn/qkimages/330a/330a202312/330a202312269-3-l.jpg">
< a rel="example_group" title="Custom title" href="http://img.resource.qikan.cn/qkimages/330a/330a202312/330a202312269-3-l.jpg">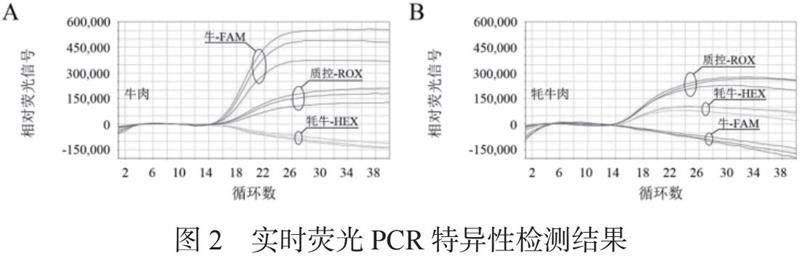 < a rel="example_group" title="Custom title" href="http://img.resource.qikan.cn/qkimages/330a/330a202312/330a202312269-4-l.jpg">
< a rel="example_group" title="Custom title" href="http://img.resource.qikan.cn/qkimages/330a/330a202312/330a202312269-4-l.jpg">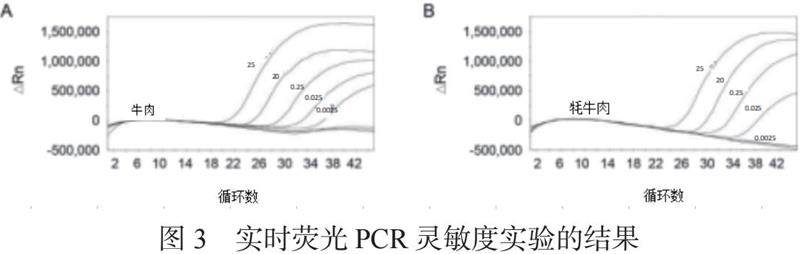

 京公网安备 11011302003690号
京公网安备 11011302003690号

