
- 收藏
- 加入书签
高中电化学常见考查题型探析
摘要:电化学知识在人教版高中化学教材中具有非常关键的地位,同时也是高考、学考必考题型之一。这部分的知识点较多,类型多样,涵盖了原电池、电解池以及金属的腐蚀与防护等内容。本文结合本章节的知识点及其常见考查题型,本文结合具体例题,详细说明电化学部分的常解题方法。
关键词:高中;电化学;考察题型
原电池及电解池的工作原理分析及其应用是高考学考的热点,在高中化学课程教学期间,必须要重点关注,需要从本质上引领学生认识原电池及其电解池的工作原理。为了引领学生掌握本章节的重点知识及其知识之间的内在联系,理解氧化还原反应的规律,教师就可以通过对比、归纳等方法,结合具体例题将知识进一步系统化,以强化学生的解题能力、思考能力。
电池种类的判别,是解决电化学题型的基础。原电池将化学能转化为电能,而电解池则将电能转化为化学能,有外接电源的为电解池,反之则为原电池;也可通过放电或者充电来判断原电池和电解池,即放电过程为原电池,充电过程为电解池。这部分考点有:
1.构成原电池、电解池的基本条件。
2.原电池、电解池工作原理
3.电极、电池方程式书写等。
为了能让学生快速得出答案,明确解题思路,可以按照计算化合价、电子的流向、得失电子的方向判断正负极或者阴阳极;电极方程式是否正确,看反应物、生成物、电荷数、以及是否运用了电解质或环境介质对反应产物的影响步骤进行思考。为了保证做题正确率。此时,教师还可以通过口诀的形式加强学生的记忆,如:负氧阳,即原电池的负极和电解池的阳极都发生氧化反应,化合价升高,失去电子。通过这样的方法,更能够加强学生对这部分知识的认知与理解。
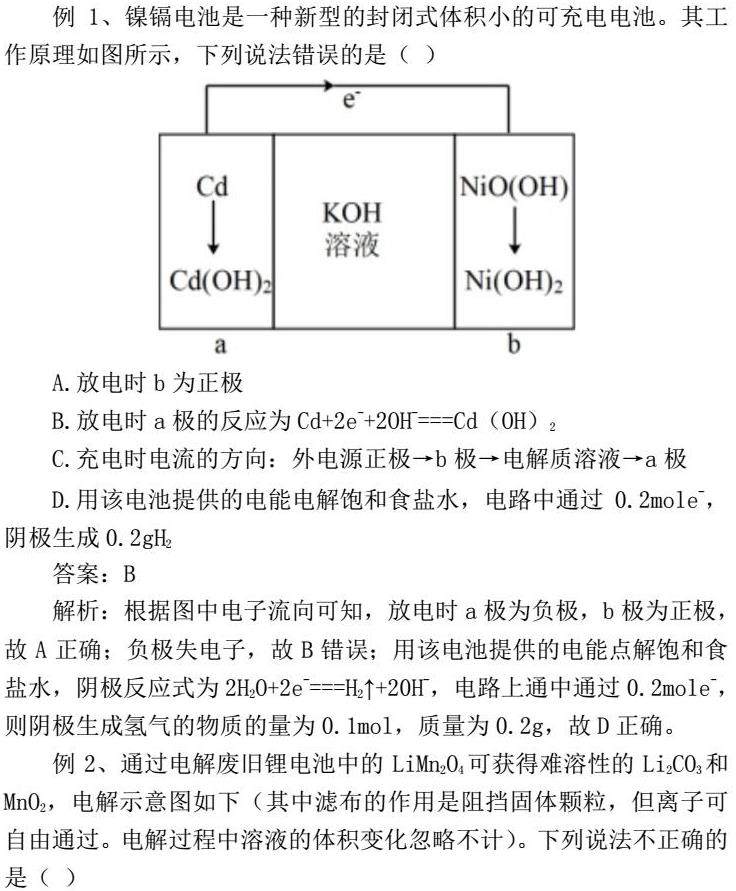
例1、镍镉电池是一种新型的封闭式体积小的可充电电池。其工作原理如图所示,下列说法错误的是 ( )
A.放电时b为正极
B.放电时a极的反应为Cd+2e-+2OH-===Cd(OH)2
C.充电时电流的方向:外电源正极→b极→电解质溶液→a极
D.用该电池提供的电能电解饱和食盐水,电路中通过0.2mole-,阴极生成0.2gH2
答案:B
解析:根据图中电子流向可知,放电时a极为负极,b极为正极,故A正确;负极失电子,故B错误;用该电池提供的电能点解饱和食盐水,阴极反应式为2H2O+2e-===H2↑+20H-,电路上通中通过0.2mole-,则阴极生成氢气的物质的量为0.1mol,质量为0.2g,故D正确。
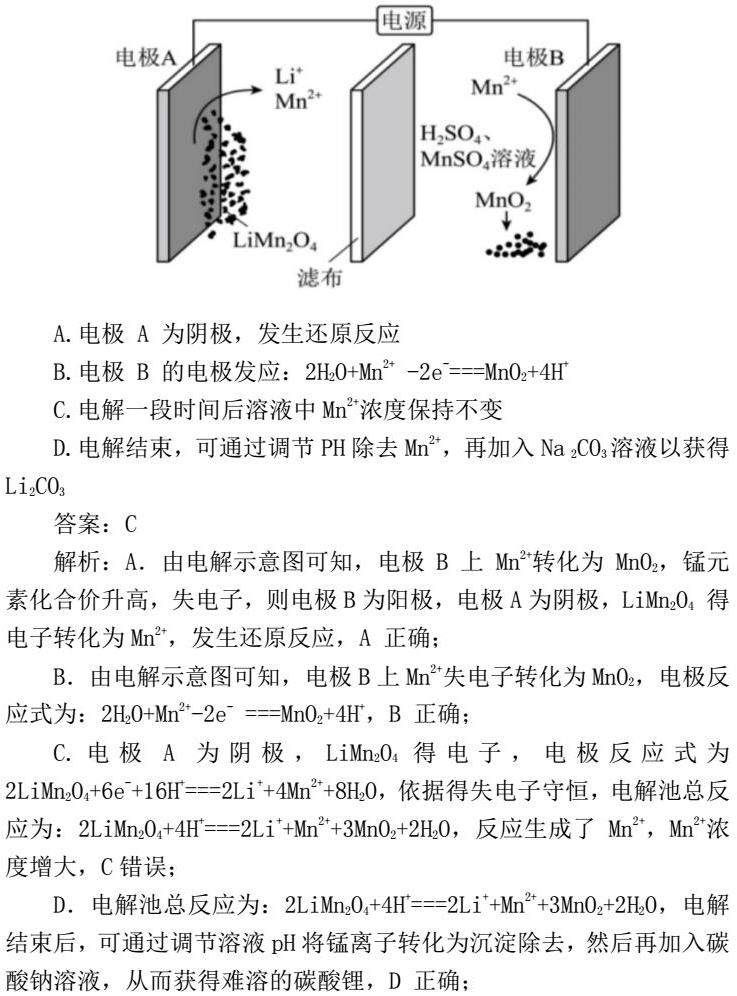
例2、通过电解废旧锂电池中的LiMn2O4可获得难溶性的Li2CO3和MnO2 ,电解示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过。电解过程中溶液的体积变化忽略不计)。下列说法不正确的是 ( )
A. 电极 A 为阴极,发生还原反应
B. 电极 B 的电极发应:2H2O+Mn2+ -2e-===MnO2+4H+
C. 电解一段时间后溶液中Mn2+浓度保持不变
D. 电解结束,可通过调节PH除去Mn2+,再加入Na 2CO3溶液以获得 Li2CO3
答案:C
解析:A.由电解示意图可知,电极B上 Mn2+转化为 MnO2,锰元素化合价升高,失电子,则电极B为阳极,电极A为阴极,LiMn2O4 得电子转化为Mn2+,发生还原反应,A 正确;
B.由电解示意图可知,电极B上Mn2+失电子转化为MnO2,电极反应式为:2H2O+Mn2+-2e- ===MnO2+4H+,B 正确;
C.电极A为阴极,LiMn2O4得电子,电极反应式为2LiMn2O4+6e-+16H+===2Li++4Mn2++8H2O,依据得失电子守恒,电解池总反应为:2LiMn2O4+4H+===2Li++Mn2++3MnO2+2H2O,反应生成了Mn2+,Mn2+浓度增大,C错误;
D.电解池总反应为:2LiMn2O4+4H+===2Li++Mn2++3MnO2+2H2O,电解结束后,可通过调节溶液pH将锰离子转化为沉淀除去,然后再加入碳酸钠溶液,从而获得难溶的碳酸锂,D 正确;
解决此类电解池题型时,可以通过思维建模,分析电解过程的思维流程:1、判断阴阳两极:明确阳极时惰性电极还是活泼性电极;2、分析电解质的离子组成:找全离子(包括水电离出的H+和OH-),并按阴、阳离子分组;3、确定放电离子或物质:排出阴、阳离子在两极的放电顺序,确定优先放电的微粒;4、写出电极反应式、总反应式:判断电极产物,注意溶液的酸碱性、产物的溶解性;5、解答具体问题,如有关离子浓度、PH、电极产物量的变化、溶液的复原等问题。
总之,在复习电化学部分的知识时,需要重点理解知识的内涵,尤其是在解析常见考查题型时,如果出现无从下手、没有思路的情况下,可以根据知识的基本规律及其所掌握的基本解题方法,结合题意,按照步骤逐字分析,以找到解题的突破口,在日常教学期间更需要加强这部分题型训练,以让学生达到举一反三的效果。
参考文献:
[1] 罗富全. 高中电化学常见考查题型[J]. 数理化解题研究,2017(7).
[2] 张承军,牟大勇. 电化学在高考中的考查[J]. 高中数理化,2023(8):62-63.






 京公网安备 11011302003690号
京公网安备 11011302003690号


