
- 收藏
- 加入书签
基于核心素养导向的高中化学走班制分层教学设计的研究
——以选择性必修1《弱电解质的电离》教学为例
摘要:最新版普通高中化学课程标准实施,明确提出发展学生学科核心素养的目标。化学学科核心素养包括了宏观辨识与微观探析、证据推理与模型认知、科学探究与创新意识、变化观念与平衡思想以及科学态度与社会责任等。对高考人才选拔方式也进行了一定的调整:“3+1+2”新高考模式下的化学走班制进行分层教学也就成为了可能。结合高中化学新课程改革的教学实际情况,以人教版高中化学选择性必修1第三章中《弱电解质的电离》为例,围绕学生认识基础,通过设置真实问题情境引入,以活动链为导向探究合作(教学活动分层设计),思考解释,迁移理解,结合多种评价方式进行教学设计,最终实现分层教学,同时也实现教学评一体化,落实化学学科核心素养。
关键词:化学核心素养;弱电解质;电离平衡;分层教学
一、研究背景
学生的化学学业水平一直存在明显的参差不齐现象。教师应及时调整教学方式及学习方式,对于不同层次学生的采用不同教法与学法,从而更好地发展学生化学学科核心素养,使学生适应现代生活和未来发展的需要,发挥化学课程的整体育人功能[1]。
在新教材、新高考背景下探究素养为本的走班式分层教学策略,对化学核心素养有效地落实到学生个体有重要意义。学生在分层教学的课堂中找到学习的信心,激发学习的自主性;分层教学的起点在于了解学生的不同,在尊重其本性的基础上,设计分层的教学内容[2],增强学生课堂学习效果,进而提高课堂教学总体质量。
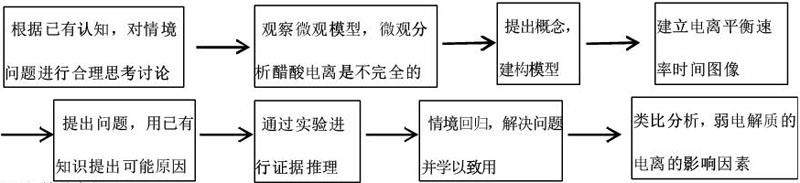
二、教学案例设计思路
(一)教学设计思路
(二)教学流程
从探究生活中的除尿垢和除水垢所选用试剂不同的原因的情景线入手,调动学生学习积极性,A班学生以小组合作的方式设计实验探究“醋酸溶液中存在电离平衡”,B班学生能通过老师引导的实验思路和提供的实验用品,能自主选择合适的实验用品进行实验验证。结合实验现象,分析实验原理,得出相关实验结论。最后在学以致用的评价任务中,A班学生要能迁移应用知识到新的情境中,B班学生能用所学知识解决本节情景线中的问题,在此过程中学生是主动参与学习过程的,多角度认识学习弱电解质的电离平衡,能突破学生的认知障碍,提高学生的化学学科核心素养。
三、主要教学过程
环节一:情境引入 激发兴趣
化学与社会生活密切相关,利用生活场景设计真实情境引入新课,引导学生使用化学学科知识解释生活现象,激发学生学习兴趣。
问题1:尿垢和水垢主要成分都为CaCO3,为什么除尿垢和除水垢所使用的试剂不同?
学生活动一:用已学知识尝试讨论试剂不同的原因(允许试错)
设计意图:从生活实例引入,发现问题,激发学生学习欲望,引出本节课内容:对电解质进行分类和学习弱电解质在水溶液中的行为特征。
环节二:微观探析 构建新知
化学学科核心素养包括了宏观辨识与微观探析,化学知识的本质往往是看不到摸不着的,通过信息技术中的动画等手段进行模拟,可以将微观情况可视化后再进行探析,是一个值得推广的教学手段。
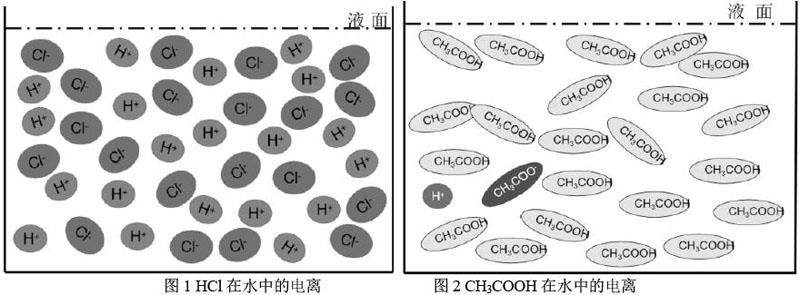
问题2:分别观看盐酸、醋酸在水中的粒子动图(图1和图2),分析为什么两种酸的电离结果不同?
学生活动二:通过小组分析讨论,得出盐酸在水中是完全电离为氢离子和氯离子的,醋酸只有少量电离为氢离子和醋酸根离子,大部分还是以醋酸分子存在水中的结论。学生自行总结归纳出强弱电解质的概念和符号表征。
设计意图:通过教师展示提供的两幅粒子动图,学生通过讨论分析,有能力根据已学知识分析并得出在水中盐酸完全电离,醋酸不完全电离的结论。教师从而顺着学生的结论给出强弱电解质的概念和符号表征方式,一切水到渠成。
环节三:类比迁移 模型认知
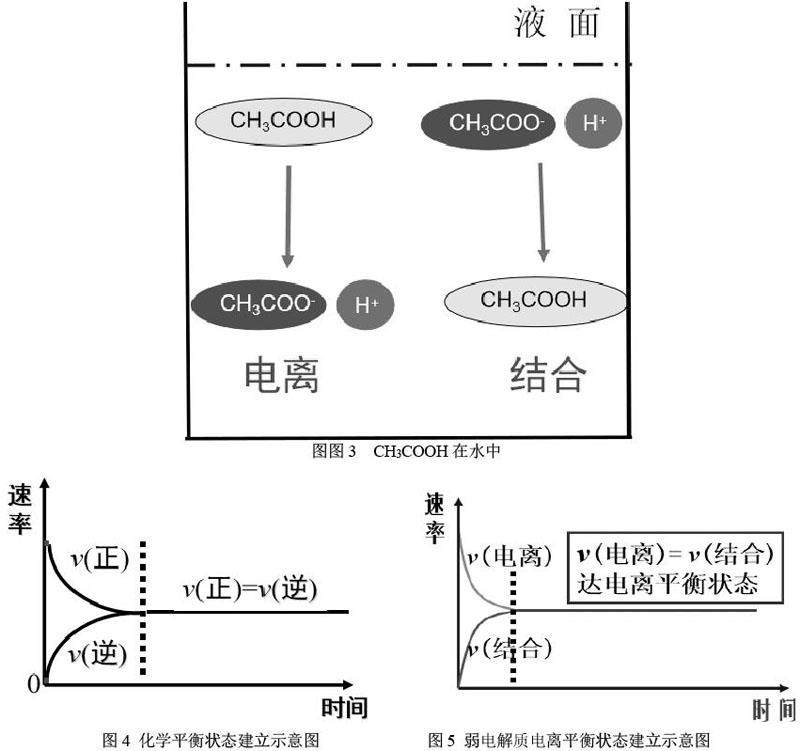
问题3:观察分析图3,醋酸分子的结合和电离与化学平衡中的什么行为相似?
学生活动三:利用已学的化学平衡的建立过程v-t曲线(从正反应方向开始的建立),尝试画出醋酸逐渐电离过程的v-t曲线。
同理,学生类比已学的化学平衡特征可推导出电离平衡的特征。
设计意图:类比迁移这个学习方法在各个学科中广泛适用,利用旧识的学习思路,迁移到新识的学习中,可以轻松掌握新识。教师引导学生类比可逆反应的化学平衡,构建可逆电离的电离平衡模型,达到完成学科素养中的模型认知目标。
环节四:关联结构 证据推理
问题4:如何证明醋酸溶液中存在电离平衡?
学生活动四:A班学生分小组讨论设计思路,按思路分别设计实验,并分组进行实验探究(提供的材料:0.1mol/L的盐酸、0.1mol/L的醋酸、pH计、水质检测笔(同温时,水质检测笔读数越大,溶液的导电性越强)、镁片、砂纸、烧杯、量筒、滴管等)
思路1:证明醋酸的电离是部分的(以完全电离的盐酸进行对照实验)
思路1的实验方案1:取相同体积0.1mol/L的盐酸和0.1mol/L的醋酸,比较它们pH值大小。
思路1的实验方案2:用水质检测笔测0.1mol/L的盐酸和0.1mol/L的醋酸的读数。该读数越大,意味着溶液中离子浓度越大,也就是导电性越强。
思路1的实验方案3:取相同体积0.1mol/L的盐酸和0.1mol/L的醋酸分别与等量的用砂纸打磨过的镁片反应,观察、比较并记录两个试管刚开始反应时的现象。
[小组汇报]选取小组进行汇报,其他小组可以补充评价。实验方案1中,0.1mol/L的盐酸的pH值约为1,0.1mol/L的醋酸的pH值约为3;实验方案2水质检测笔在0.1mol/L的盐酸的读数大于0.1mol/L的醋酸;相同体积0.1mol/L的盐酸和0.1mol/L的醋酸分别都能与用砂纸打磨过的镁片反应,刚开始反应时盐酸中产生的气泡更多更快。以上,因为盐酸的电离是完全的,通过实验现象对比,可以得出醋酸的电离是部分的结论。
思路2:通过电离平衡的移动来证明平衡的存在。
思路2的实验方案1:取两份相同体积0.1mol/L的醋酸,一份常温,一份放入热水中,比较它们pH值大小。
思路1的实验方案2:取两份相同体积0.1mol/L的醋酸,一份加入等体积的水,比较它们pH值的倍数情况。
问题5:已知弱电解质的电离平衡是吸热的,通过以上你们设计的实验,如何分析所得数据证明电离平衡发生了移动?用什么原理分析?
[小组汇报]选取小组进行汇报,其他小组可以补充评价。实验方案1,现象是:常温下0.1mol/L的醋酸的pH值约为3,放入热水的0.1mol/L的醋酸的pH值小于3。分析如下:根据勒夏特列原理,平衡会向吸热的方向移动,所以升温后醋酸分子更多地变成了氢离子和醋酸根离子,溶液总体积不变,所以氢离子的浓度变大,所以pH值变小。实验方案2,现象是:原体积的0.1mol/L的醋酸的pH值约为3,即氢离子的浓度约为10-3mol/L,加入等体积的水的醋酸溶液的pH值换算为氢离子浓度大于5X10-4mol/L。分析如下:根据勒夏特列原理,平衡会向减少变化的方向移动。结论:以上两个方案均可证明电离平衡发生了移动,且电离平衡的移动的影响因素与化学平衡的移动都遵循勒夏特列原理。
学生活动四:B班学生,教师根据所给出的实验用品,引导学生分析思路。得出两个思路方案后,根据思路1,再引导学生可以根据对比实验验证实验结论。学生分小组进行实验探究(提供的材料:0.1mol/L的盐酸、0.1mol/L的醋酸、pH计、水质检测笔(同温时,水质检测笔读数越大,溶液的导电性越强)、镁片、砂纸、烧杯、量筒、滴管等)
设计意图:化学反应原理学习中是非常需要落实化学学科核心素养中的证据推理的。高中化学的学习,不能只停留在表面的是什么,而是要探究为什么,探究的过程就是寻找证据的过程。A班的学生思维层次相对高,自主学习能力也相对高,他们有能力通过自主讨论得出实验方案的思路,并分组完成实验探究与结果分析,最后通过教师点评、生生互评进行补充或纠正,得出正确结论。B班的学生思维层次与自主学习能力相对不高,但通过教师设置问题,一步一步引导学生完成本环节的任务,最后任务完成时要大力表扬和肯定学生,建立学习的自信心,对后续的学习才不会有惧怕的心理。
环节五:回扣主题 学以致用
学生活动五:A班学生,自行写出用洁厕灵除尿垢的离子方程式、用食醋除水垢的离子方程式。并解析为什么要用洁厕灵(盐酸)除尿垢、为什么用食醋除水壶汇中的水垢:同浓度条件下盐酸中的c(H+)大于醋酸中c(H+),浓度越大,反应速率越快,去污速率越快;盐酸是强电解质,酸性较强,可能会腐蚀不锈钢材质的水壶,所以使用酸性较弱的醋酸除水垢。
学生活动五:B班学生,应用本节所学知识解析为什么要用洁厕灵(盐酸)除尿垢、为什么用食醋除水壶汇中的水垢。
设计意图:关注知识的综合应用,利用本节课所学的知识解决生活中的实际问题,进一步提升勒夏特列原理的应用。
环节六:分层作业布置。
A班学生:1.下列物质前者是强电解质、后者是弱电解质的是( )
A.KNO3 CH3COOH B.HCl NaHSO4
C.NaCl BaSO4 D.H2SO4 氨水
2.下列物质在水溶液中的电离方程式正确的是( )
A.H2SO4===H++SO42- B.CH3COOH===CH3COO-+H+
C.NaHCO3===Na++H++CO32- D.2H2O H3O++OH-
3. c(H+)相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌已全部溶解且放出气体一样多,则下列说法正确的是( )
A.反应开始时的速率:甲>乙
B.反应结束时的c(H+):甲<乙
C.反应开始时的酸的物质的量浓度:甲=乙
D.反应所需时间:甲<乙
4.浓度均为0.1mol/L的盐酸(甲)和醋酸(乙),分别加等量的水进行稀释,进行分析并绘画出溶液中的c(H+)-t图(两份溶液的变化曲线画在同一个图中); c(H+)相等的盐酸(甲)和醋酸(乙),分别加等量的水进行稀释,进行分析并绘画出溶液中的c(H+)-t图(两份溶液的变化曲线画在同一个图中)。(勒夏特列原理的应用)
B班学生:1.下列物质前者是强电解质、后者是弱电解质的是( )
A.KNO3 CH3COOH B.HCl NaHSO4
C.NaCl BaSO4 D.NH3·H2O H2SO4
2.下列物质在水溶液中的电离方程式正确的是( )
A.H2SO4===H++SO42- B.CH3COOH===CH3COO-+H+
C.NaHSO4===Na++HSO42- D.H2O H++OH-
3.下列说法正确的是( )
A.HR溶液的导电性较弱,HR属于弱酸
B.某化合物溶于水导电,则该化合物为电解质
C.根据电解质在其水溶液中能否完全电离,将电解质分为强电解质和弱电解质
D.食盐是电解质,食盐的水溶液也是电解质
4.醋酸是电解质,下列能说明醋酸是弱电解质的组合是( )
①醋酸与水能以任意比例互溶
②白醋中滴入石蕊溶液呈红色
③0.1 mol·L-1醋酸的pH比0.1 mol·L-1的盐酸的pH大
④蛋壳浸入白醋中有气体放出
⑤大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生H2的速率慢
A.②⑤ B.③⑤ C.③④⑤ D.①②
设计意图:不同层次的学生学习新知识的重点难点不同,根据学生实际情况,设计难度和形式分层的作业,这样才能激发学生的兴趣和创造力。
结语
分层教学的理论基础之一是巴班斯基“教学过程最优化”理论,其意旨在教学活动的过程中教师能够在资源最简化、精力时间最少化的基础上实现最大利益化的教学效果,即实现“投入少收益大”的教学过程[3]。分层教学模式是尊重学生主体地位,体现学生本位的教育理念。经实践研究发现,化学走班制分层教学的实施无论是对学生的学习兴趣、学习动机、思维能力等因素的影响都比较明显。分层教学可以满足不同层次学生的个性化需求,充分体验进步感和成功感。也培养了学生的自主学习能力和合作精神,积极参与活动,主动思考问题,增强学生的责任感与自信心。
参考文献:
[1]国家中长期教育改革和发展规划纲要工作小组办公室.国家中长期教育改革和发展规划纲要(2010-2020 年)[EB].北京:教育部,2010.
[2]王晓丹. 高中化学分层走班教学实践研究[D].华中师范大学,2018.
[3]徐丽芳. 基于不同“选考组合”的分层走班教学对高中生化学学习动机的影响研究[D].湖南师范大学,2018.
广州市教育研究院2021年度科研课题+面上课题+《基于核心素养导向的高中化学走班制教学案例的研究——以选择性必修1为例》(课题编号:21AJCJY21016)






 京公网安备 11011302003690号
京公网安备 11011302003690号


