
- 收藏
- 加入书签
4种中药制剂微生物限度检查方法的适用性试验
摘要:目的:建立本实验室日常检验4种中药制剂的微生物限度的检查方法。方法:按照《中国药典》2020年版的规定,对本实验室日常检验4种中药制剂的微生物限度进行方法适用性试验。分别采用常规法、增加稀释液法、增加培养基体积法和增加稀释液-增加培养基体积联合法,进行方法适用性试验。结果:感冒清热颗粒、双黄连颗粒的需氧菌总数,采用增加稀释液法;双黄连口服液和枫蓼肠胃康合剂需氧菌总数,选择增加稀释液-增加培养基体积联合法,4种中药制剂的霉菌和酵母菌总数和控制菌检查均可采用常规法。结论:确立了本实验室日常检验4种中药制剂的微生物限度的检查方法。
关键词:微生物限度;增加稀释液法;增加稀释液-增加培养基体积联合法
【中图分类号】 R97 【文献标识码】 A 【文章编号】2107-2306(2022)10--02
前言:《中国药典》2020年版四部通则1105非无菌产品微生物限度检查,指出如供试品有抗菌活性,应尽可能去除或中和。供试品的微生物计数方法应进行方法适用性试验,以确认所采用的方法适合于该产品的微生物计数。若检验程序或产品发生变化可能影响检验结果时,计数方法应重新进行适用性试验[1]。
本实验对日常检验的几个品种:感冒清热颗粒、双黄连口服液、双黄连颗粒、枫蓼肠胃康合剂进行方法学适应性试验,建立本实验室这几个品种的微生物限度检查方法。具体过程如下:
1 仪器与材料
1.1仪器
生化培养箱(型号:LRH-250F,上海一恒科学仪器有限公司),生化培养箱(型号:PYH-150S-B,广东韶关科力实验仪器有限公司),二级生物安全柜(型号:BSC-1000ⅡA2,苏净安泰空气技术有限公司)
1.2试药
感冒清热颗粒(批号:A厂家201277、B厂家1021061);双黄连颗粒(批号:200108);双黄连口服液(批号:20201008B);枫蓼肠胃康合剂(批号:201104)。
1.3培养基
胰酪大豆胨液体培养基(TSB),批号2005083(北京三药);胰酪大豆胨琼脂培养基(TSA),批号181029(北京陆桥);麦康凯液体培养基,批号201222(北京三药);麦康凯琼脂培养基,批号1812072(北京三药);沙氏葡萄糖琼脂培养基(SDA),批号190228 2(北京三药);pH7.0氯化钠-蛋白胨缓冲液(稀释液),批号191212(北京三药)。
1.4试验菌株
金黄色葡萄球菌[CMCC(B)26003]、铜绿假单胞[CMCC(B)10104]、枯草芽孢杆菌[CMCC(B)63501]、白色念珠菌[CMCC(F)98001]、黑曲霉[CMCC(F)98003],大肠埃希菌[CMCC(B)44102]均来源于中国食品药品检定研究院,试验菌株均在3代-5代之间。
2 方法
按《中国药典》2020版四部通则1105、1106、1107要求,确定口服给药项下的固体制剂和液体制剂(不含药材原粉的中药制剂)需检查需氧菌总数,霉菌和酵母菌总数,控制菌检查大肠埃希菌。
2.1 菌液制备
2.1.1按文献[1]方法将1.4项下的菌种(除大肠埃希菌)制成每0.1mL含菌数100~999cfu的菌悬液。
2.1.2按文献[1]方法将大肠埃希菌制成每0.1mL含菌数10~99cfu的菌悬液。
2.2 供试液制备
按文献[2]、[3]方法,将1.2项下样品按 1∶10、1∶50、 1∶100比例稀释,即得。
2.3需氧菌总数、霉菌和酵母菌总数的方法适用性试验
2.3.1常规法
试验组:取1:10供试液9.9 mL,加入制备好的2.1.1项下的菌液0.1mL,混匀;
供试品组:取1:10供试液9.9mL,加稀释液0.1mL,混匀;
菌液组:取稀释液9.9mL,加入制备好的2.1.1项下的菌液0.1mL,混匀;
阴性组:取稀释液。
取上述各试液2mL注皿(1mL/皿),加入15~20mL温度不超过45℃熔化的
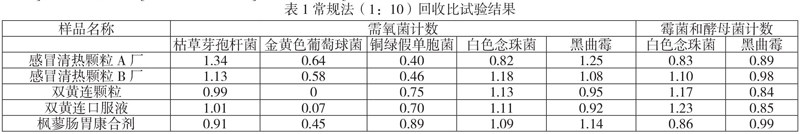
TSA/SDA培养基,混匀,凝固,倒置培养,计算平均菌落数[2]。按[回收率=(试验组平均菌落数-供试品组平均菌落数)/菌液组平均菌落数]计算回收率,结果见表1。
结果分析:霉菌和酵母菌总数:4种制剂采用1:10供试液常规法回收比值均在0.5-2.0之间,表明可用常规法进行霉菌和酵母菌总数的检查。
需氧菌总数:常规法1:10供试液,感冒清热颗粒(A厂、B厂)铜绿假单胞菌的回收比都小于0.5,双黄连颗粒和双黄连口服液金黄色葡萄球菌的回收比值接近0,表明其均有较强的抑菌性,枫蓼肠胃康合剂金黄色葡萄球菌的回收比值也没有达到0.5,所以选择用增加稀释液法继续进行方法适应性试验。
2.3.2增加稀释液法
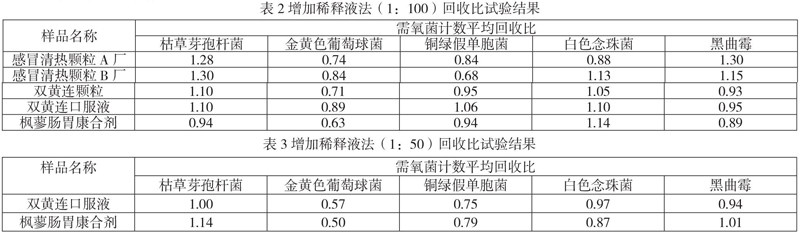
取2.1.1项下菌液0.1mL,分别加 到1∶50 、1:100供试液9.9 mL中,混匀,作为试验组,其他同2.3.1项,取2mL注皿(1mL/皿),加入15~20 mL温度不超过45℃熔化的TSA培养基,混匀,凝固,倒置培养,计算平均菌落数。结果见表2、表3。
结果分析:感冒清热颗粒(A厂、B厂)、双黄连口服液、双黄连颗粒、枫蓼肠胃康合剂的需氧菌总数,样品稀释100倍,各试验菌的回收比值均在0.5-2.0之间;但是双黄连口服液和枫蓼肠胃康合剂需氧菌总数限度为102CFU/mL,供试品的可稀释空间不大,而且这两种制剂1:50稀释液金黄色葡萄球菌的回收比值还是在0.5边缘,应该选择增加稀释液-增加培养基体积联合法继续进行方法适用性试验。
2.3.3 增加稀释液-增加培养基体积联合法
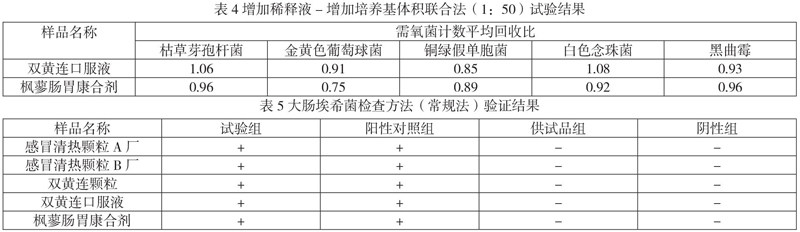
取2.1.1项下菌液0.1mL,分别加 到2.2项下1∶50供试液9.9m中,混匀,作为试验组,其他同2.3.1项,取1mL注皿(0.2mL/皿) ,加入15~20mL温度不超过45℃熔化的TSA培养基,混匀,凝固,倒置培养,计算平均菌落数。结果见表4。
结果分析:双黄连口服液和枫蓼肠胃康合剂需氧菌总数,选择增加稀释液-增加培养基体积联合法,取 1:50稀释液1mL注皿( 0.2mL/皿),各试验菌的回收比值均在0.5-2.0之间。表明该方法可以用于这两种制剂的需氧菌总数检查。
2.4 控制菌检查方法适用性验证(常规法)
试验组:取1:10供试液10mL及2.1.2项下的大肠埃希菌菌液0.1mL加到100mLTSB中,混匀;
阳性对照组:取2.1.2项下的大肠埃希菌菌液0.1mL加到100mLTSB中,混匀;
阴性组:取10mL稀释液加到100mLTSB中,混匀;
供试品组:取1:10供试液10mL加到100mL TSB中,混匀。按照文献[1]的方法检查,结果见表5。
结果分析: 感冒清热颗粒(A厂、B厂)、双黄连口服液、双黄连颗粒、枫蓼肠胃康合剂大肠埃希菌用常规法均检出阳性菌,而阴性组均无菌落生长,表明可用常规法进行控制菌的检查。
3 讨论
中国药典2015年版以整合先进理念,借鉴吸收国外先进技术经验,兼顾国情为主要原则对微生物限度检查法做了较大修订【3】。《中国药典》2020年版四部通则,微生物限度检查法1105较2015年版药典的改动不大,主要是文字方面的修订。如果在《中国药典》2015年版实施后,对相应的品种重新进行方法学适应性试验,方法的变化应该是不大的。
但是经过这几年的监督抽检检验,对比厂家的方法和查阅相关文献【4】-【8】,不同企业不同品种或者同一品种的微生物限度检查方法适用性存在不同的情况,除了一些对方法的理解错误,加菌量,加菌方式错误外,有些直接沿用《中国药典》2010年版验证的方法,以回收率70%以上判断方法可不可行。如果按《中国药典》2015版,2020版,回收比在0.5-2.0之间的要求,很多按《中国药典》2010年版用薄膜过滤的品种,用稀释法即可以满足中国药典要求,原先稀释法的品种用常规法即可满足中国药典要求。
虽然很多文献[9]-【11】中都提及建议国家收集资料整理分析,出台一些具体品种的的微生物限度检查标准,以方便药品监督抽查检验,但经过了这么多年,并没有落实,实际工作中只能是各个检验机构在检验中不断积累总结各个品种的适用性试验方法,制定本单位的相关品种相应厂家的微生物限度检验方法,形成本单位的一个完整合理的检验方法体系,对今后的检验工作提供了有利的帮助。
参考文献:
国家药典委员会.中华人民共和国药典: 2020年版四部[S].北京:中国医药科技出版社,2020: 161-163.
[2]中国食品药品检定研究院. 中国药品检验标准操作规范[S].北京:中国医药科技出版社,2019: 442-443.
[3]杨晓丽,李辉,马英英,绳金房,胡昌勤.《中国药典》2015年版非无菌产品微生物限度检查:控制菌检查法解读与对策[J].中国药师,2016,19(4):748-752.
[4]刘康连,庞云娟,周晓婷.5 种同名异型中药制剂微生物限度检查法的建立与结果分析[J].中 成 药,2017,39(7):1515-1518.
[5]杜春华,张晓南,游燕,李东娴,王鹏,曹红云.含有金银花的3种中药制剂的微生物限度与控制菌检查法的建立及方法学验证[J].中药与临床,2018,9(3):19-21,29.
[6]张乔,张琦,李静,姜德友,孟云阁.双黄连口服液与颗粒剂微生物限度检查方法的研究.中医药信息,2018,35(02):53-56.
[7]张秀花,刘艳平,曲国晶.复方丹参片微生物限度检查方法的建立.中国药品 标准,2020,21(5):464-471.
[8]马鸣晓.地市级药检所开展无菌和微生物限度检查方法学验证工作之我见[J].中国药师,2008,11( 9) : 1105-1106.
[9]吴潇.近年来我国药品微生物限度检查方法验证概况[J].中国现代药物应用,2008,2( 20) : 115-117.
[10]庞云娟,樊文研,刘康连,梁 洁. 药品微生物限度检查方法学验证的研究进展[J].中成药,2017,39(10):2137.






 京公网安备 11011302003690号
京公网安备 11011302003690号


