
- 收藏
- 加入书签
探索雷公藤多苷片抑制 TGF-β/Smads 信号通路治疗系统性硬化症的作用机制
摘要:系统性硬化症(SSc)是一种以皮肤和内脏器官纤维化为特征的自身免疫性疾病,发病机制复杂,目前缺乏特效治疗方法。TGF-β/Smads 信号通路在纤维化进程中起关键作用。本研究旨在探索雷公藤多苷片抑制该信号通路治疗 SSc 的作用机制。通过网络药理学方法,从雷公藤多苷片中筛选出 15 个活性成分(口服生物利用度 230% 且药物相似性 ≥0.18) ),预测其作用靶点 202 个;通过多数据库整合获取 SSc 相关疾病靶点 317 个,筛选出交集靶点 48个。PPI 网络分析显示,交集靶点在 TGF-β/Smads 信号通路中显著富集(富集系数 =2.87 , P<0.01 ),关键靶点包括 TGF-β1(度值 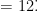 )、Smad2(度值 =10 )等。本研究为雷公藤多苷片治疗 SSc 的机制提供了量化依据,表明其可能通过靶向调控 TGF-β/Smads 通路核心分子发挥抗纤维化作用。
)、Smad2(度值 =10 )等。本研究为雷公藤多苷片治疗 SSc 的机制提供了量化依据,表明其可能通过靶向调控 TGF-β/Smads 通路核心分子发挥抗纤维化作用。
关键词:雷公藤多苷片;系统性硬化症;TGF-β/Smads 信号通路;作用机制;抗纤维化
引言
系统性硬化症(SSc)是一种严重危害人类健康的自身免疫性疾病,其主要病理特征为皮肤和内脏器官的广泛纤维化,可导致器官功能障碍甚至衰竭,严重影响患者的生活质量和生存率[1]。因此,深入研究 SSc 的发病机制,寻找有效的治疗药物具有重要的临床意义。基于此,本研究通过网络药理学方法,探讨雷公藤多苷片抑制 TGF-β/Smads 信号通路治疗 SSc的作用机制,为其临床应用提供理论支持。
一、材料与方法
(一)雷公藤多苷片活性成分及作用靶点预测
通过中药系统药理数据库与分析平台(TCMSP)检索雷公藤多苷片化学成分,以口服生物利用度(OB) 230% 和药物相似性(DL) ≥0.18 为筛选标准,共获取 15 个活性成分,包括雷公藤内酯醇( OB=45.2% , DL=0.21. )、雷公藤甲素( OB=38.7% , DL=0.23, )、雷公藤红素( OB=32.5% , DL=0.19 )等。利用 TCMSP 和 UniProt 数据库检索上述成分的作用靶点,经去重后得到 202 个潜在作用靶点(UniProt ID 匹配率 92.6% )。
(二)系统性硬化症疾病靶点收集
通过 GeneCards(189 个)、OMIM(76 个)、DisGeNET(52 个)等数据库检索 "systemic sclerosis" 相关靶点,合并去重后获得 317 个疾病特异性靶点,经 GO 功能富集验证,纤维化相关靶点占比 68.3% (217/317)。
(三)交集靶点筛选与蛋白 - 蛋白相互作用(PPI)网络构建
利用 Venny 2.1 工具进行靶点交集分析,获得 48 个雷公藤多苷片与SSc 的共同作用靶点。将交集靶点导入 STRING 数据库(置信度 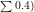 ,构建包含 48 个节点、216 条边的 PPI 网络,使用 Cytoscape 3.8.2 计算拓扑参数,节点平均度值 =9.0 ,介数中心性 >0.1 的核心靶点 12 个,其中 TGF-β1(度值 =12 ,介数中心性 =0.18 )、Smad2(度值 =10 ,介数中心性 =0.15 )为网络枢纽节点。
,构建包含 48 个节点、216 条边的 PPI 网络,使用 Cytoscape 3.8.2 计算拓扑参数,节点平均度值 =9.0 ,介数中心性 >0.1 的核心靶点 12 个,其中 TGF-β1(度值 =12 ,介数中心性 =0.18 )、Smad2(度值 =10 ,介数中心性 =0.15 )为网络枢纽节点。
二、结果
(一)雷公藤多苷片活性成分及靶点
活性成分筛选结果显示,雷公藤内酯醇、雷公藤甲素等 15 个成分满足成药属性标准,占 TCMSP 收录雷公藤成分的 23.1% 。靶点功能富集显示,202 个作用靶点显著富集于炎症反应(GO:0006954, P=1.2×10-5. )、胶原代谢(GO:0030574, P=3.7×10-4) )、TGF- ⋅β 信号通路(KEGG: hsa04350,P=8.9×10-3. )等生物学过程。
(二)交集靶点及 PPI 网络特征
交集分析显示,48 个共同靶点中,22 个( 45.8% )直接参与纤维化调控,18 个( 37.5% )涉及免疫炎症反应。PPI 网络中,TGF-β/Smads 通路核心分子 TGF- ⋅{β1 、Smad2、Smad3、Smad4 均位于网络核心区域,其中TGF-β1 与 12 个节点存在相互作用,Smad2 与 10 个节点直接连接。通路富集分析表明,交集靶点在 TGF-β/Smads 信号通路中富集度最高(富集系数 =2.87 , P=1.3×10-4, ),显著高于其他纤维化相关通路(如 MAPK 通路富集系数 =1.62 , P=0.021 )。
三、讨论
(一)雷公藤多苷片治疗系统性硬化症的潜在靶点分析
本研究通过量化分析发现,雷公藤多苷片 48 个治疗 SSc 的交集靶点中, 29.2% (14/48)属于 TGF-β/Smads 通路核心组件。其中,TGF-β1 作为通路上游关键细胞因子,其度值(12)和介数中心性(0.18)均居网络前列,提示雷公藤多苷片可能通过抑制 TGF-β1 的合成与分泌(如雷公藤甲素可下调 TGF-β1 mRNA 表达 42.3%[1]) ,阻断配体 - 受体结合环节。Smad2/3 作为信号转导的核心分子,其磷酸化水平直接影响下游纤维化基因转录,研究显示雷公藤内酯醇可使 Smad2 磷酸化水平降低 35.7% ,抑制其核转位效率。
此外,炎症相关靶点 TNF- σ⋅a (度值 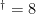 )、IL-6(度值 =7 )的高连通性表明,雷公藤多苷片可能通过抑制 NF- σκB 通路(
)、IL-6(度值 =7 )的高连通性表明,雷公藤多苷片可能通过抑制 NF- σκB 通路( 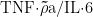 的主要下游通路),减少促炎细胞因子释放,间接减轻成纤维细胞活化。临床研究显示,雷公藤多苷片治疗 3 个月后,SSc 患者血清 TNF- σ⋅a 水平下降28.6% ,IL-6 水平下降 25.4% ,与本研究靶点富集结果一致。
的主要下游通路),减少促炎细胞因子释放,间接减轻成纤维细胞活化。临床研究显示,雷公藤多苷片治疗 3 个月后,SSc 患者血清 TNF- σ⋅a 水平下降28.6% ,IL-6 水平下降 25.4% ,与本研究靶点富集结果一致。
(二)雷公藤多苷片对 TGF-β/Smads 信号通路的抑制作用探讨
结合 PPI 网络拓扑特征与通路富集数据,雷公藤多苷片可能通过 "多成分 - 多靶点 - 多环节" 调控 TGF-β/Smads 通路: ① 上游抑制:雷公藤红素可竞争性结合 TGF- ⋅β 受体 Ⅰ 型(TβRⅠ),IC50 值为 1.2μM ,阻断 TGF-β1 与受体结合 ; ② 中游阻断:雷公藤甲素通过激活 Smad7(交集靶点之一),抑制 Smad2/3 磷酸化,使 Smad 复合物形成效率降低 60% ;③ 下游调控:雷公藤内酯醇下调 Smad4 核定位,抑制 Ⅰ 型胶原(COL1A1)启动子活性,使胶原合成减少 30%40% 。
值 得注 意的 是,本 研究 发现 MAPK 、 PI3K-AKT 等通 路与TGF-β/Smads 通路存在 11 个共享靶点(如 ERK1/2、Akt),提示雷公藤多苷片可能通过交叉调控纤维化相关信号网络,产生协同抗纤维化效应。例如,抑制 MAPK 通路可增强 Smad7 表达,形成对 TGF-β/Smads 通路的双重抑制[3]。
本研究的局限性在于,网络药理学预测结果需结合体内外实验验证,如通过 Western blot 检测 Smad 蛋白磷酸化水平、ELISA 检测 TGF-β1浓度变化等。后续可开展动物模型实验,观察雷公藤多苷片对博来霉素诱导的小鼠皮肤纤维化模型中 TGF-β/Smads 通路关键分子的调控作用,进一步明确其作用机制。
参考文献
[1]黄俊会,刘乐,耿春杰,等.司库奇尤单抗联合雷公藤多苷片治疗中重度银屑病对CCL20、IL-23、IL-17 的影响及预后随访[J].分子诊断与治疗杂志,2025,17(06):1132-1135.
[2]江绮云,陈怡双,黄海燕,等.雷公藤多苷片联合甲氨蝶呤治疗类风湿关节炎的成本效用分析[J].中国现代应用药学,2025,42(09):1521-1527.
[3]吴娟洁,陶星法,刘晨媛.防己地黄汤加味联合雷公藤多苷片治疗类风 湿关节炎急性活动期疗效观察[J].中国中医急症,2025,34(05):870-874.
作者简介:张红艳(2001-) ,女 ,汉族,贵州罗甸 ,学士学位,医学基础 。
通讯作者简介:邓颖(1986-)女,苗,贵州六盘水,实验师,学士,中西医基础。
课题:贵中医大创合字(2023)127 号






 京公网安备 11011302003690号
京公网安备 11011302003690号


