
- 收藏
- 加入书签
基于数字化实验促进高中化学“四重表征”课堂教学 以“离子反应”为例
摘要:离子反应是元素化合物知识的理论依据,也是选修模块水溶液中离子平衡、电化学基础的生长点,具有承前启后的作用,是高中化学非常重要的理论基础知识。借助数字化实验探究离子反应本质,可以使微观变化可视化,宏观现象数字化、曲线化、直观化,突破学习障碍点,加强学生落实“宏—微—符—曲”四重表征,落实学生宏观辨识与微观探析、证据推理化学学科核心素养发展。
关键词:离子反应 数字化实验 四重表征
《普通高中化学课程标准(2017版2020年修订)》提出要重视信息技术的应用,鼓励适当增加数字化实验[1]。在教育信息化背景下,将数字化实验与传统的实验教学相融合,一方面可以改变传统实验教学方式,另一方面弥补了部分传统实验的缺陷,将化学微观变化中难以观察到的现象,通过宏观数据和曲线等数学表征形式呈现,促进学生“宏—微—符—曲”四重表征,加深学生对抽象的化学知识的理解,本文以离子反应为例[2],结合数字化实验让学生通过观察实验曲线变化过程,认识离子反应的本质,突破重难点;通过问题层层设问,引导学生认识离子反应的条件和离子方程式的书写,构建离子反应的思维模型。
一、教材分析
离子反应是对学生理性认识初中四大基本反应类型的补充,也是对物质间的转化深入认识的内容。通过分析掌握化学反应的实质,本节内容的特点是概念多、理论性强、抽象。在呈现方式上,教材中通过实验引入离子反应的概念,充分发挥实验在化学概念形成过程中的重要作用,如实验现象清晰、直观,有利于调动学生学习化学的兴趣和积极性等;另一方面注重基于实验证据一般为宏观现象进行分析,逐步引导学生归纳总结出离子反应微观本质,同时可以引导学生探究电离和离子反应的概念模型,体会模型在观察化学现象、解释化学反应原理的本质和用“离子符号”进行表征中所发挥的重要作用。离子反应的学习也为选择性必修一教材中“溶液中的离子反应”的学习奠定必要的基础,是中学化学教学的重点和难点之一,同时也是学业水平考试的高频考点。
二、学情分析
在学习本节课之前,学生在初中的学习过程中已经了解了酸碱盐溶液知识,知道了酸碱盐溶液能导电,初步认识了电解质、复分解反应的相关知识以及电解质电离产生离子的条件,会书写常见强电解质的电离方程式;已学习的化学反应类型有四大基本反应,这些反应类型又与离子反应有交叉重叠,只有更加深入地揭示反应的本质,才能激发学生对本节课的学习热情。在前面的学习中,教师通过引导,培养了学生利用实验分析解决问题的能力,学生逐渐掌握透过现象看本质,找出事物变化的规律的学习方法。在高中来会进一步深入学习电解质的电离和离子反应的相关内容,这部分内容是有难度的,学生在学习中对离子方程式的书写是难以理解和掌握的。同时,离子反应的本质及条件也是重点,尽量从实验出发,宏微结合,证据推理,树立数据作为证据的意识,引导学生掌握重点、突破难点,顺利地完成本部分知识的学习。
三、教学与评价目标
1.教学目标
(1)通过观察3个化学反应的导电率一时间变化的曲线,初步建立离子反应本质的认识过程。
(2)通过观察实验现象,认识离子反应,归纳离子反应的条件。
(3)形成离子反应是有条件的观念,认识离子之间发生反应遵循一定的规律,理解离子间的反应存在定量关系。
2.评价目标
(1)通过对学生预测和解释实验变化曲线的数据分析,诊断学生对离子反应本质的认识水平。
(2)通过对书写离子反应方程式的交流和点评,发展学生对离子反应表征的认识水平。
四、教学过程
教学环节一:提出问题 引入新课
【教师】提出问题并演示动画将NaOH溶液与CuSO4溶液混合后,溶液中的离子还会存在吗?
【学生】观察动画并思考问题
【设置意图】通过演示动画,观察现象,使学生进入问题情境
教学环节二:利用数字化实验探究离子反应本质
【教师】介绍数字化实验的仪器和使用原理,并设置实验探究离子反应本质
【实验设计】实验试剂:0.1 mol·L-1CuSO4溶液、0.1 mol·L-1BaCl2溶液、0.1 mol·L-1NaOH溶液、0.1 mol·L-1HCl溶液。
实验仪器:导电率传感器及其数据采集器和其它实验仪器。
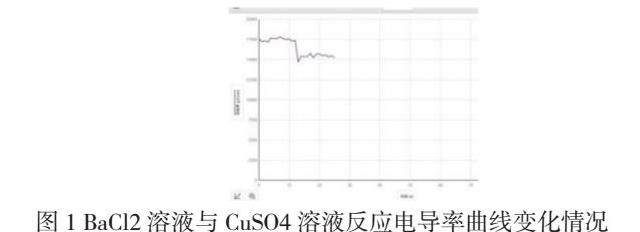
【演示实验1】BaCl2溶液与CuSO4溶液反应
【教师】解释曲线的下降并写出相应的化学方程式
【学生】混合后铜离子和氯离子还在溶液中,而硫酸根离子和钡离子结合生成硫酸钡沉淀,不在溶液体系了,导致溶液中离子浓度减少。方程式:BaCl2+CuSO4=BaSO4↓+CuCl2
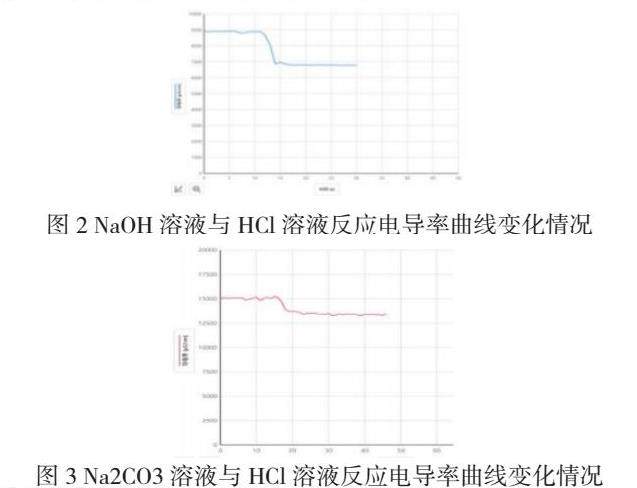
【演示实验2】NaOH溶液与HCl溶液反应
【教师】解释曲线的下降并写出相应的化学方程式
【学生】混合后钠离子和氯离子还在溶液中,而氢离子和氢氧根离子结合生成水分子,导致溶液中离子浓度减少。方程式:NaOH+HCl=NaCl+H2O
【演示实验3】Na2CO3溶液与HCl溶液反应
【教师】解释曲线的下降并写出相应的化学方程式
【学生】混合后氢离子和碳酸根离子结合生成二氧化碳气体和水,导致溶液中离子浓度减少。
方程式:Na2CO3+HCl=NaCl+H2O+CO2↑
【教师】提出问题:电解质溶液之间的化学反应是否有离子参加?反应前后溶液中离子浓度如何变化?
【学生】电解质溶液之间的化学反应有离子参加,生成沉淀、气体、水造成离子浓度的减少。
【引出概念】
离子反应:有离子参加或生成的反应。
离子反应的本质:离子浓度的减少,也是判断离子反应发生的依据。
【设置意图】通过观察视频、动画展示和曲线变化的方式,从生成沉淀、气体和水的现象证据与导电率随时间下降的数据证据,认识离子反应的本质是离子浓度的减少,最后通过化学方程式表征,促进学生“宏—微—符—曲”四重表征,加深学生对离子反应本质的理解。
教学环节三:离子反应发生的条件
【教师】提出问题:是否所有的离子间都可以发生离子反应?
【学生】不是,实际参加反应的离子浓度减少才可以发生离子反应。
【教师】那么请同学们思考哪些情况可以导致离子浓度的减少,归纳离子反应发生的条件
【学生】生成沉淀、气体和水
【教师】生成沉淀气体和水可以归为一类,就是这些离子从溶液中脱离出去,水很难电离出H+和OH-,我们可以把生成水这种情况进行拓展,哪些物质也能导致离子浓度减少?
【学生】弱电解质(弱酸、弱碱、水)
【教师】归纳总结离子反应发生的条件:生成沉淀、气体和弱电解质(弱酸、弱碱、水)
五、教学反思
通过李克特式5点评价量表对该节课进行问卷调查,调查学生对本节课教学目标的完成情况。测试结果证明了本文通过三个实验探究利用导电率传感器检测溶液中离子浓度的变化,认识离子反应的概念和本质。取得了满意的教学效果,大部分同学都理解了离子反应的本质,在实验探究上传统实验与数字化实验相结合,运用“宏—微—符—曲”四重表征寻找现象证据和数据证据,发展了学生宏观辨识和微观探析,证据推理等化学核心素养。
在当前教育信息化背景下,传统的实验化学教学应当与时俱进,而利用数字化实验与传统实验相融合,能够解决微观变化不能宏观化的问题,使得微观变化过程通过曲线表征宏观化,加强学生对化学学科知识本质的理解。
参考文献
[1]中华人民共和国教育部.普通高中化学课程标准(2017 年版).北京:人民教育出版社,2018
[2]黄澎清.基于数字化实验的离子反应教学研究[J].中学化学教学参考,2022,(06):51-52.






 京公网安备 11011302003690号
京公网安备 11011302003690号


