
- 收藏
- 加入书签
药品微生物限度检查方法学验证试验及其相关的技术问题
摘要:本文选择合适的方法对不同方式与药物直接接触的材料微生物限度进行分析和测试,并研究和证明了该方法的实用性。根据《中国药典》(2020版)第四部分附录的一般规定和相应的药包材国家标准,验证微生物限度检查法的适用性。结果表明金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、黑曲霉等5种标准菌株菌落计数回收率约为60~150%,均符合中国药典的规定。这是通过控制细菌来证实的。在所有试验中,可检测到相应的试验菌株,本法适用于各种药材的细菌限度检查。
关键词:药品微生物限度;检查方法;验证试验;技术问题
药品包装和容器对药品有特殊用途,直接接触药品可能影响药品安全。微生物污染也是医疗包装容器中医疗信息产品质量管理可能面临的主要风险问题之一。因此,如果要确保用药过程的安全性和有效性,就需要严格控制包装容器中微生物污染的严重程度。由于药物包装容器的材料组成、生产工艺和储存要求等多种因素,表面附着微生物的数量和类型将受到影响。同时,在检验和分析方法上,收集和研究附着在样品表面的微生物。供试品溶液生产过程中主要涉及提取介质及具体制备方法可能会对微生物环境造成一定的破坏,影响细菌的生长,对检测的准确性有很大的影响。同时,微生物检测结果的准确性还受到许多其他因素的影响,如样品分布的均匀性、样品溶液生产过程中微生物采集的准确性、检测和分析方法的敏感性,上述内容一般在标准方法中有详细规定,以保证实验方法的科学性。但各实验点必须验证标准方法在实验室适用范围内,并确保实验室人员的实验动作、试验环境、培养基和试剂不影响方法的实验结果,以确保试验结论的正确性。
1仪器与材料
1.1仪器
生化细胞培养箱thermo815(ThermoFisher);高压产生的蒸汽在锅炉mLs-3780(日本三洋公司)中进行消毒;ESCO生物安全柜classiBSc(易思高科技有限公司)。
1.2实验用标准菌株
BioballMultishot550系列定量质量管理菌株,包括金黄色葡萄球菌和金黄色葡萄球菌(NCTC10788b3651)、铜绿假单胞菌、铜绿假单胞菌NCTC12924(批号:B3653)、枯草芽孢杆菌(B)NCTC10400(批号:B3647)、白色念珠菌(C)(批号:B3663)、黑曲霉(尼日尔)NCPF2275(批号:B3642)、大肠杆菌(大肠杆菌)NCTC12923(批号:B3661)。
1.3培养基及试剂
色氨酸琼脂培养基(TSA)干粉、色氨酸液体培养基(TSB)干粉、SDA干粉、麦凯液体培养基干粉、麦凯琼脂培养基干粉、十六烷基三甲基溴化铵琼脂培养基干粉、甘露醇氯化钠琼脂培养基干粉等均来自上海中科冲生物技术开发公司。
1.4实验样品
本试验中使用的样品为每日试验样品,平皿法计数时,取试验可能用的最低
稀释级供试液1ml和50~100cfu试验菌,分别注入平皿中,立即倾注琼脂培养基,每株试验菌平行制备2个平皿,按平皿法测定其菌数。薄膜过滤法计数时,取规定量试验可能用的最低稀释级供试液,过滤,冲洗,应在最后一次的冲洗液中加入50~100cfu试验菌,过滤,按薄膜过滤法测定其菌数。
1.5菌液的制备
将约550个不同生物圈复合细菌的小球添加到1.1mL,14d复合细菌溶液中,并搅拌形成标准实验细菌溶液(即500CFU/mL标准菌株)。
1.6供试液及滤膜的制备
1.6.1垫片、膜、药用瓶、铝管等
医用生物聚酯纤维/铝/聚丙烯材料密封垫、聚酯非织造布或外贴用粘合膜、口服药物输送用药瓶、铝管和各种软膏管固定,分别符合YBB00132005-2015、YBB00132002-2015的要求,根据YBB0162002-2015微生物检测等项目的技术要求,在研究试液影响后,取标准中相当于一个工作单元(一片或垫片、100c㎡粘结膜材料、一个玻璃瓶、一根铝管)的试液进行检验,分析后对膜进行过滤。
1.6.2气雾剂阀门
取10份样品,置于锥形杯中,加入100mL氯化钠注射液,摇匀1分钟,得到1:10的试液。取10mL供试品溶液,在膜下过滤。
1.6.3口服固体药用瓶盖
取10个无菌棉签,用氯化钠混合注射剂湿润,用外部垂直杆在瓶盖上摩擦,可立即产生剪切应力后,将棉签注入含有100mL氯化钠注射剂的双锥玻璃瓶中,然后更换另一个棉签并使用相同的方法(即用两个棉签多次摩擦每个目标瓶盖)。快速摇动瓶子1分钟,以获得1:10的试液。使用10mL样品溶液进行膜过滤。
1.6.4滤膜的冲洗
每个滤膜应清洗3次,每种清洗液和液体的总表面积约为50mL。按照《中华人民共和国药典》(2020版)第四部分通则1105检查滤膜上的需氧细菌、霉菌和酵母菌数量,并按《中华人民共和国药典》(2020版)第四部分通则1106检查对照细胞数。
1.6.5菌落计数和控制菌检验
根据2020版《药典》(四部)通则1107规定,耳用制剂控制菌检查包括铜绿假单胞菌和金黄色葡萄球菌。
1.7方法适用性验证
根据文献进行需氧菌、霉菌和酵母菌总数以及对照菌方法的验证试验。添加的标准品为不同菌量的50CFU溶液,即上述标准品1.5中的0.1mL菌液。平均回收率(%)=(试验C组细菌数、试样对照组细菌数)/溶液对照组细胞数×10%。当五株标准菌株的平均回收率为50%-200%时,判定为合格。
2结果
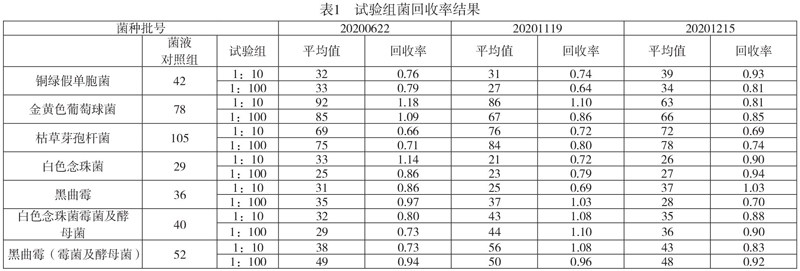
实验研究结论数据表明,不同标准菌株对回收率的影响为63%~143%,见下表1。改进后的包装材料的微生物检测技术及控制限制,实验方法适用于需氧菌、芽孢杆菌、霉菌和酵母。
在对照菌的验证和通过试验中,金黄色葡萄球菌和铜绿假单胞菌实验组和细菌溶液对照组在非织造布、气雾阀、药物复合膜材料、铝管和软膏管方面的实验发展结果为阳性,而对照组的样本均为阴性。实验结果表明,三种方案对细菌控制的适用性符合药典规定的标准,并选择作为7种包装材料的微生物限度检测方案。
3讨论
本实验分析了金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌感染和黑曲霉五种检测控制标准。回收率试验结果为63-143%,符合国家药典2020年版四部1105通则50%-200%的规定。大肠杆菌、金黄色葡萄球菌和铜绿假单胞菌的生长控制方法也已验证符合《中国药典》(2020版)第四部分通则1106的规定。
对于各种药包材的商品,应选择合理、准确的检验方法,以证明所选方法的适用性,从而确认所选方法和标准的准确性,使商品的检验结论更加正确、合理。
综上所述,本文提出的这一检验方式精准可靠,在实施期间,同样需要注意相应因素的管控,以确保检验质量。
参考文献:
[1]庞云娟,樊文研,刘康连,梁洁.药品微生物限度检查方法学验证的研究进展[J].中成药,2021,39(10):2137-2140.
[2]庞云娟.40个中成药的微生物限度检查法的方法学验证研究[D].广西中医药大学,2021,05(15):115-119.
[3]马韵韵.丁细牙痛胶囊微生物限度检查方法学验证试验研究[J].生物技术世界,2020,07(12):152-155.
[4]马韵韵.枫蓼肠胃片微生物限度检查方法学验证试验研究[J].生物技术世界,2020,17(04):120-123.






 京公网安备 11011302003690号
京公网安备 11011302003690号


