
- 收藏
- 加入书签
基于健康体检人群血清脂蛋白相关磷脂酶A2水平分布特征分析及参考区间研究
摘 要:目的:分析健康体检人群血清脂蛋白相关磷脂酶A2(Lp-PLA2)水平的分布特征,建立适合本地区的参考区间。方法:选取3360 例健康体检人群,按性别、年龄分组,检测血清Lp-PLA2 水平,分析其分布特征,并与已有参考区间对比。结果:不同性别、年龄组的血清Lp-PLA2水平存在差异,男性高于女性( P<0.05 ),青年组和中年组血清Lp-PLA2水平基本持平,老年组血清Lp-PLA2水平相对较低(P<0.05 )。本研究建立的参考区间与国外及部分国内报道有所不同。结论:健康体检人群血清Lp-PLA2水平受性别、年龄等因素影响,各实验室应建立自己的参考区间以更好地服务临床。
关键词:脂蛋白相关磷脂酶A2;健康体检人群;分布特征;参考区间
1.引言
动脉粥样硬化性心血管疾病是全球范围内的主要健康威胁,其发病率和死亡率呈上升趋势[1]。炎症在动脉粥样硬化的发生、发展过程中起着关键作用,脂蛋白相关磷脂酶A2(Lp-PLA2)作为一种具有血管特异性的炎症标志物,近年来受到广泛关注[2]。研究表明,Lp-PLA2水平与冠心病、缺血性卒中等心血管疾病的风险密切相关[3-5]。准确了解健康体检人群Lp-PLA2水平的分布特征及参考区间,对于早期识别心血管疾病高危人群、制定个性化的预防和治疗策略具有重要意义。
2.材料与方法
2.1 研究对象
选取2023年11月至2024年11月在本实验室进行健康体检的人群3360 例,其中男性2509例,平均年龄( 43.67±13.54. )岁;女性851例,平均年龄( 48.49±15.39 )岁。所有体检者均基于常规健康体检筛查,未报告明确的心血管疾病、脑血管疾病、糖尿病等慢性疾病史,且近期未服用影响血脂代谢的药物。由于体检人群的健康状态主要依赖于自我报告及常规体检筛查,不排除部分人员可能存在未被发现的潜在疾病或异常过高值数据。为确保研究数据的可靠性,对血清 Lp-PLA2 异常水平进行了初步筛查,并剔除了可能受异常因素影响的离群数据。
2.2 检测方法
采集所有研究对象清晨空腹静脉血 5ml ,以 3000r/min 的速度离心 10min ,分离血清。采用磁微粒化学发光免疫分析法测定血清Lp-PLA2水平,设备及试剂均由北京热景生物技术股份有限公司提供,设备型号为C2000。严格按照试剂盒说明书进行操作。同时详细记录研究对象的性别、年龄等基本信息。
2.3 分组方法
按性别分为男性组和女性组;按年龄分为18-39岁青年组(1361例,平均年龄( 30.44±4.99 )岁)、40-59岁中年组(1560例,平均年龄( 50.38±5.73 )岁)、60-80岁老年组(439例,平均年龄( 66.57±5.53 )岁)。
2.3 统计学分析
运用 SPSS 25.0 软件进行统计学处理。计量资料以均数 ± 标准差(  )表示,组间比较采用独立样本t检验和F检验分析;计数资料以频数和百分比表示,组间比较采用 χ; ²检验,以P <0.05 为差异具有统计学意义。采用正态分布法确定Lp-PLA2的参考区间。
)表示,组间比较采用独立样本t检验和F检验分析;计数资料以频数和百分比表示,组间比较采用 χ; ²检验,以P <0.05 为差异具有统计学意义。采用正态分布法确定Lp-PLA2的参考区间。
3.结果
3.1 健康体检人群血清Lp-PLA2水平的总体分布
3360例健康体检者的平均年龄为 44.89±14.18 岁,血清Lp-PLA2水平为 148.46.±44.88ng/mL ,具体见图1。
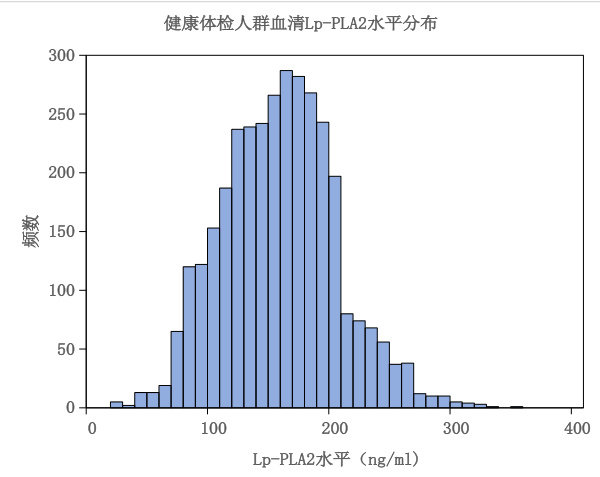
3.2 不同性别血清Lp-PLA2水平的差异
在3360例体检者中,女性有851例,平均年龄为 48.49±15.39 岁, 血 清Lp-PLA2水 平 为 129.27±38.39ng/mL ;男性有2509例,平均年龄为 43.67±13.54 岁,血清Lp-PLA2水平为 154.91±44.88ng/ mL。经独立样本t检验,男性Lp-PLA2水平显著高于女性(t=17.861, P<0.05 )。见表1。

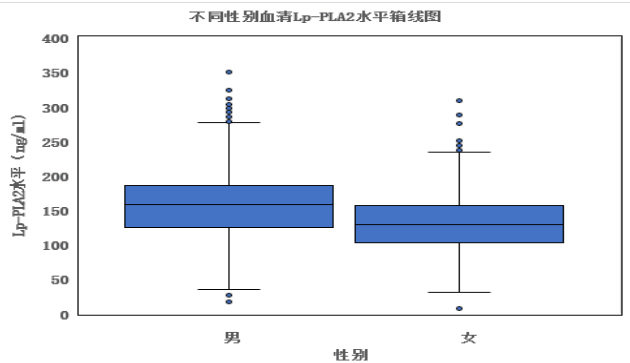
3.3 不同年龄组血清Lp-PLA2水平的差异
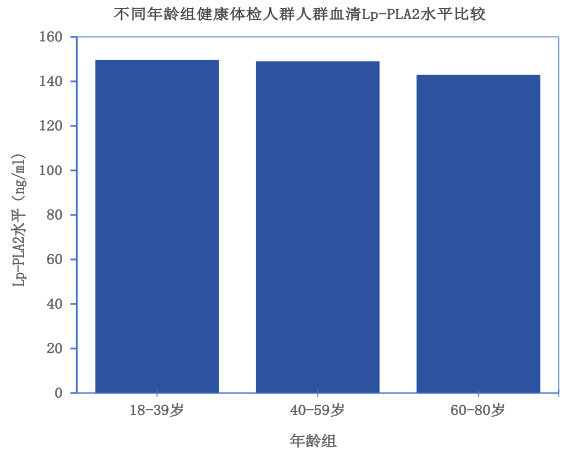
18-39岁 青 年 组 血 清Lp-PLA2水 平 为( 149.64±44.17) ng/ml,40-59岁中年组为( 149.04±45.59 ) ng/ml ,60-80岁老年组为( 142.93±44.55 ) 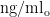 。青年组和中年组血清Lp-PLA2水平基本持平,老年组血清Lp-PLA2水平相对较低,见图3,方差分析结果显示,进一步两两比较发现,老年组与青年组、中年组相比,差异有统计学意义( P<0.05 ),而青年组与中年组之间差异无统计学意义( P>0.05 )。具体见表2。
。青年组和中年组血清Lp-PLA2水平基本持平,老年组血清Lp-PLA2水平相对较低,见图3,方差分析结果显示,进一步两两比较发现,老年组与青年组、中年组相比,差异有统计学意义( P<0.05 ),而青年组与中年组之间差异无统计学意义( P>0.05 )。具体见表2。
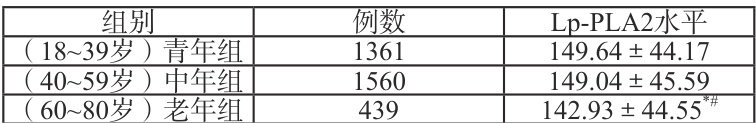
注:与青年组对比, ⋆P<0.05 ;与中年组对比,#P <0.05 。
3.5 健康体检人群血清 Lp - PLA2 参考区间的建立
通过对3360例健康体检人群血清Lp-PLA2水平的检测数据进行分析,采用 95% 可信区间法来建立本地区健康人群的参考区间。在计算过程中,首先对所有数据进行正态性检验,经检验,数据基本符合正态分布。
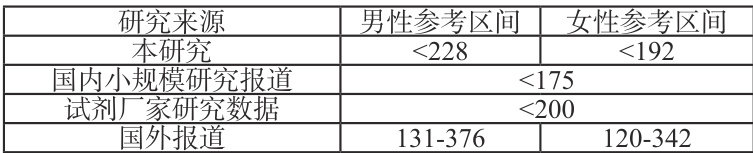
基于此,计算得出本地区健康体检人群血清Lp-PLA2的单侧参考区间为:男性 <228ng/ml ,女性 <192ng/mlℓ 。这一参考区间的建立具有重要的临床意义,为后续临床诊断和疾病风险评估提供了本地化的参考标准。
为进一步验证该参考区间的合理性,将其与相关文献报道进行比较。国外某研究对大量不同种族人群的研究中,确定的成人血清Lp-PLA2参考区间男性为(131-376) ng/ml (平均 251ng/ml ),女性为(120-342) ng/ml (平均 174ng/ml )。国内一项小规模研究提示Lp-PLA2水平 <175ng/ml 为正常,本研究使用的检测系统热景厂家研究数据是Lp-PLA2水平 <200ng/ml 。具体比较见表3。
从对比结果可以看出,本研究建立的参考区间与国外及国内不同地区报道存在一定差异。这种差异可能由多种因素造成。从种族因素来看,不同种族人群的基因背景存在差异,可能影响 Lp - PLA2的表达和代谢过程,进而导致参考区间有所不同。在生活方式方面,不同地区人群的运动量、吸烟饮酒习惯、饮食习惯等都不尽相同。例如,经常吸烟、饮酒以及运动量较少的人群,其Lp-PLA2水平可能会受到影响。另外,检测方法和仪器的不同也可能导致参考区间存在偏差。不同的检测试剂、检测仪器的灵敏度和准确性存在差异,这些因素在参考区间的建立过程中都起着重要作用。
因此,各地区在临床应用中,应充分考虑本地区人群的特点,建立适合本地的血清Lp-PLA2参考区间,以提高临床诊断的准确性和可靠性,为疾病的早期预防和治疗提供更有价值的依据。
4.讨论
4.1 性别对血清Lp-PLA2水平的影响
本研究明确显示,男性健康体检人群血清Lp-PLA2水平显著高于女性,这一结果与国内外诸多研究结论相契合[6]。在生活习惯层面,男性群体中吸烟、饮酒等不良习惯的占比较高。香烟中的尼古丁、焦油等有害物质以及酒精,可通过激活体内的炎症信号通路,刺激血管内膜中的巨噬细胞、T 细胞和肥大细胞等分泌Lp-PLA2,进而提升其血清水平[7]。
从激素调节角度分析,雄激素对Lp-PLA2的合成具有促进作用。雄激素能够与细胞内的雄激素受体相结合,形成复合物并转位至细胞核,与特定基因的启动子区域结合,上调Lp-PLA2基因的表达,增加其合成量[8]。与之相反,雌激素对Lp-PLA2可能存在抑制作用。雌激素可通过调节脂质代谢,减少氧化低密度脂蛋白的生成,而氧化低密度脂蛋白是Lp-PLA2的主要作用底物,底物减少间接影响Lp-PLA2的活性和水平。此外,雌激素还可能通过抑制炎症细胞的活性,减少Lp-PLA2的分泌。临床实践中,鉴于男性较高的Lp-PLA2水平,对于男性心血管疾病风险的评估应将Lp-PLA2作为重点监测指标,以便早期发现潜在风险,采取针对性的干预措施。
4.2 年龄对血清Lp-PLA2水平的影响
不同年龄组健康体检人群血清Lp-PLA2水平呈现出明显差异,老年组Lp-PLA2水平相对较低。从免疫系统角度来看,随着年龄增长,老年人的免疫系统发生衰退,表现为免疫细胞数量减少、活性降低,炎症反应的调控能力减弱。巨噬细胞、肥大细胞等分泌Lp-PLA2的能力也随之下降,导致血清中Lp-PLA2水平降低。
由于体检人群的健康状态主要为常规体检筛查以及患者自述疾病史,不排除部分人员可能存在未被发现的潜在疾病,在慢性疾病与药物影响方面,老年人常合并多种慢性疾病,如高血压、糖尿病、冠心病等。以高血压为例,长期的血压升高可引起血管内皮损伤,激活体内的炎症反应,影响Lp-PLA2的代谢。同时,老年人因慢性疾病长期服用的药物,如降压药、降糖药、他汀类药物等,也可能对Lp-PLA2水平产生影响。例如,他汀类药物在降低血脂的同时,还具有抗炎作用,可能通过抑制炎症反应,减少Lp-PLA2的分泌[9]。而18-39岁青年组和40-59岁中年组Lp-PLA2水平相近,表明在成年后的较长阶段内,身体的内环境相对稳定,对Lp-PLA2的调节机制未发生显著改变。这可能与该年龄段人群免疫系统功能较为稳定,慢性疾病患病率相对较低有关。
4.3 参考区间的差异
本研究建立的健康体检人群血清Lp-PLA2参考区间与国外及国内部分地区报道存在显著差异。种族因素方面,不同种族人群的基因多态性不同,影响Lp-PLA2的基因表达和酶活性。例如,某些种族的特定基因变异可能导致Lp-PLA2的合成效率或降解速率发生改变,进而影响其血清水平[10]。非洲裔人群与亚裔人群相比,可能具有不同的Lp-PLA2基因单核苷酸多态性,导致Lp-PLA2的表达和活性存在差异,最终反映在参考区间上。
生活习惯方面,不同地区人群的饮食结构、运动量、吸烟饮酒习惯等存在巨大差异。在饮食方面,西方人群饮食中富含饱和脂肪和胆固醇,这种饮食模式可促进Lp-PLA2的分泌,使其血清水平相对较高。而亚洲部分地区人群以谷物、蔬菜为主的饮食结构,可能导致Lp-PLA2水平相对较低[11]。运动量方面,经常进行体育锻炼的人群,体内的炎症反应水平较低,Lp-PLA2的分泌也相应减少。吸烟和饮酒习惯对Lp-PLA2水平的影响在性别差异部分已阐述。
检测方法和仪器的差异同样不容忽视。不同的检测系统 可能导致检测结果存在偏差。例如,化学发光免疫分析法与酶联免疫吸附试验相比,其检测的灵敏度和特异性可能有所不同,从而影响参考区间的建立[12]。检测仪器的精度和稳定性也会对结果产生影响。因此,各实验室必须依据本地区人群的具体特点,建立专属的血清Lp-PLA2参考区间,以提升临床诊断的精准度,为疾病的早期预防和治疗提供可靠依据。
综上所述,本研究分析了健康体检人群血清Lp-PLA2水平的分布特征,发现性别、年龄等因素对Lp-PLA2水平有影响,男性高于女性,老年组低于青年组和中年组。同时,本研究建立的参考区间与其他报道存在差异。因此,临床在应用Lp-PLA2进行疾病诊断和风险评估时,应充分考虑性别、年龄等因素,并使用本地区的参考区间,以更好地为临床服务。因本研究老年组数据偏少,各年龄段人群分布不均,且对于体检人群不能完全排除个别人员未能提供准确的疾病史及用药史,可能会对数据产生一定的影响,研究具有局限性。未来,还需要进一步扩大样本量,并且通过关联数据同步检测分析,识别可能存在的关联的疾病,深入研究不同因素对Lp-PLA2水平的影响机制,为疾病的防治提供更有力的依据。
参考文献
[1]蔺亚晖,龚美亮,张鹏,等.中国50岁以上表观健康人群多中心外周血脂蛋白相关磷脂酶A2质量浓度参考区间研究[J].中华检验医学杂志, 2021, 44(1):7.
[2]左玮玮,郭泓江.颈动脉CTA评估颈动脉粥样硬化狭窄程度及与血清脂蛋白相关磷脂酶A2,血管生成素样蛋白8水平的相关性分析[J].陕西医学杂志, 2025(1).
[3]田雪,黄柳,姚菁青,等.血清脂蛋白相关磷脂酶A2水平与颈动脉粥样硬化斑块的相关性分析[J].中华全科医学, 2022, 20(11):1848-1851.
[4]中国老年学学会心脑血管病专业委员会.脂蛋白相关磷脂酶A2临床应用专家建议[J].中华心血管病杂志, 2015(21期):9-9.
[5]熊燕华,张大庆.《脂蛋白相关磷脂酶A2临床应用中国专家建议》解读[J].中国医药导刊, 2018, 20(3):8.
[6]胡大一.脂蛋白相关磷脂酶A2临床应用专家建议[J].中华心血管病杂志, 2015(10):5.
[7]中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国脑血管病一级预防指南2019[J].中华神经科杂志, 2019,052(009):684-709.
[8]费菲.最新解读《脂蛋白相关磷脂酶A2临床应用中国专家建议》--第26届长城国际心脏病学会议(GW-ICC)暨亚太心脏大会2015现场回顾[J].中国医药科学, 2015, 000(021):4-8.
[9]王峰,张海燕,陈玉.血清脂蛋白相关磷脂酶A2,胱抑素C和白细胞介素-6与急性脑梗死患者神经功能缺损程度及短期预后的关系[J]. 2023(1).
[10]贺翔渝,潘燕,张小林.血清脂蛋白相关磷脂酶A2水平与急性缺血性脑卒中病情及预后的关系[J].临床荟萃, 2023, 38(4):315-318.
[11]孙晓慧,贺静,王瑶,等.血清脂蛋白相关磷脂酶A2水平与冠状动脉病变程度及慢血流的相关性分析[J].临床医学研究与实践, 2023, 8(26):9-12.
[12]金璐,胡丹,丁芳芳.血清脂蛋白相关磷脂酶A2和同型半胱氨酸及凝血四项指标在高血压合并急性脑梗死预后评估中的应用价值[J].当代医学, 2023, 29(9):22-25.
作者简介
冯涛(1974.11.5-),女,学历:本科,籍贯:安徽,职称:主管技师,专业:医学检验,科室:免疫室,研究方向:临床免疫学方向。






 京公网安备 11011302003690号
京公网安备 11011302003690号


