
- 收藏
- 加入书签
基于教、学、评一体化的高中化学复习课教学实践与探索
——以《化学1》第一章物质及其变化复习课为例
摘要:本文以人教版《化学1》第一章物质及其变化的核心知识离子反应和氧化还原反应为复习主线,以建立从物质分类和核心元素化合价两种角度探究物质性质的认知模型为教学目标,通过理论分析和实验探究,以完成三个真实情境下的教学任务为教学评价切入点,旨在培养学生整合已有知识解决实际问题的学科核心素养和关键能力。探索复习课上实现核心知识串联,开展化学日常学习评价的有效途径、方式和策略。
关键词:教、学、评一体化;氧化还原反应; 高中化学复习课;
1 教学实践的背景分析
实施“教、学、评”一体化,有效开展化学日常教学评价是《普通高中化学课程标准(2017年版2020年修订)》(以下简称“新课标”)在实施建议中明确提出的核心要求,应树立“素养为本”的化学学习评价观,紧紧围绕化学学科核心素养的发展水平和化学学业质量标准来确定化学学习评价目标,注重过程性评价和结果性评价的有机结合,充分发挥评价促进学生化学学科核心素养全面发展的功能。化学日常学习评价是化学教学不可或缺的有机组成部分,是化学学习评价的一种重要表现形式,是实施“教、学、评”一体化教学的重要链条[1]。优质的化学日常学习评价对于促进学生化学学科核心素养发展具有重要作用,教师课堂教学中潜移默化的培养,有助于学生逐步内化核心观念。否则,就会使学生感到“上课听得懂、考试却不会”或“考试与上课是两张皮”的现象。这意味着在“新课标”理念下,教师的教、学生的学以及教学评价应具有高度的一致性与融合性,且需要紧密围绕化学学业质量标准予以实施,以促进学生学科核心素养的发展。
如何在课堂教学中有效实施“教、学、评”一体化,针对第一章教学特点,在掌握氧化还原反应基本概念的基础上,内化氧化还原反应并应用元素化合价升降守恒的规律解决实际问题往往是学生比较欠缺的能力。如何帮助学生建立思维模型?提高解决问题的能力?笔者在执教人教版《化学1》第一章物质及其变化的复习课中,以两大核心知识,即物质分类和氧化还原反应为复习主线,以建立从物质分类和物质核心元素化合价两种角度探究物质性质的认知模型为教学目标,通过理论分析和实验探究完成三个真实情境下的教学任务为教学评价切入点,诊断学生对于本章物质分类、离子反应和氧化还原反应规律的达成情况,培养学生学科核心素养和关键能力。探索复习课上实现知识串联,探索开展化学日常学习评价的有效途径、方式和策略。
2 教、学、评一体化理念下的教学整体设计
2.1 目标导向——基于课标解读
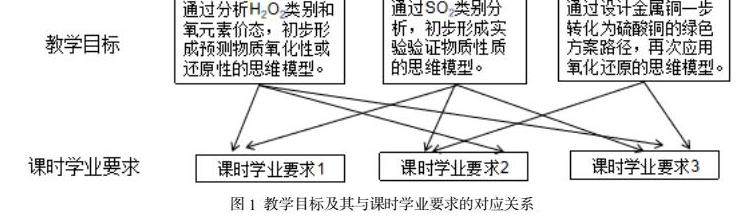
根据“新课标”中主题2:“常见的无机物及其应用”的主题内容要求,细化和解读出本节复习课的课时内容要求和课时学业要求(见表1)
基于上述解读,抽提出本节复习课教学需聚焦的主要教学任务是:如何应用氧化还原反应原理设计实验验证过氧化氢的氧化性和还原性?如何设计探究实验验证SO2的性质?如何设计转化流程实现金属铜一步转化为硫酸铜?结合教学情境创设,与课时学业要求匹配如下:(见图1)
2.2 复习课的设置与实施
教学前布置学案,使学生提前知晓教学内容,提高课堂教学效果。学案设计如下:
[课前预习] 判断正误
1、H2O2既属于酸性氧化物又属于碱性氧化物( )
2、SO2属于碱性氧化物( )
3、KI具有还原性( )
4、KMnO4具有氧化性( )
[学以致用] 任务一 基于物质核心元素价态探究H2O2的性质
1、核心元素价态分析:H2O2中氧元素显示 价,氧元素其它常见化合价有:____价、____价。
2、提出理论依据:若H2O2中氧元素化合价降低,则H2O2被____(填“氧化”或“还原”,下同),故,H2O2应该具有____性,可做____剂,还原产物是____;-1价的氧元素化合价还可能升高被____,所以,H2O2可能具有____性,可做____剂,氧化产物是____。
3、设计实验
① 验证H2O2是否具有氧化性
[知识链接] KI是常见的一流还原剂,KI的电离方程式是____,淀粉-KI试纸由浸润在淀粉-KI混合溶液中的滤纸晒干后得到,淀粉溶液遇I2变蓝。反应流程式如下:
(教学课件截图1,下同)
淀粉-KI试纸上滴加H2O2溶液预期实验现象是:
相关反应离子方程式是:
② 验证H2O2是否具有还原性
[知识链接] KMnO4是常见的王牌氧化剂,KMnO4的电离方程式是____,因KMnO4中的Mn元素显示 价,是锰元素最高价态;故,Mn元素化合价已没有升高的可能,只有降低的可能,则,KMnO4能发生____反应,得到相应还原产物____ 。
[知识拓展] 在酸碱性的不同条件下KMnO4的氧化性不同,相应的还原产物也有区别。KMnO4在酸性条件下氧化性最强,中性其次,碱性最弱。在酸性条件下,高锰酸钾被还原为无色Mn2+;中性和弱碱性条件下还原成黑色的MnO2沉淀。反应流程式如下:
(教学课件截图2)
酸性KMnO4溶液中加入H2O2溶液预期实验现象是:____
相关反应离子方程式是:____
任务二 基于物质组成与类别探究SO2的性质
①写出SO2与NaOH溶液反应的离子方程式:____
②写出SO2与水反应的化学方程式:____
③写出SO2与CaO反应的化学方程式:____
以上三个反应属于一类相同的反应类型是:____
请设计两个实验证明SO2发生了反应:①____ ②____
任务三 设计转化方案,将金属Cu经一步反应转化为CuSO4
Cu CuSO4若实现此转化需要加入 剂,可以加入的物质是
写出相关反应的离子方程式
3 教学设计思路
4 课堂实录
[教师] H2O2我们在初中就有所了解,该物质可以分解制取氧气。通过前期的学习我们已经知道,可以基于物质的组成和类别预测物质的性质,也可以基于物质的核心元素价态预测物质的性质。在物质分类的学习中,我们认识了氧化物的再分类,H2O2显然属于氧化物,从其性质再细分,H2O2属于过氧化物,而不属于酸性氧化物或是碱性氧化物,为什么?
[生1] 因为H2O2不具备酸性氧化物或碱性氧化物的性质,不能与酸或碱反应生成盐和水。
[教师] 目前,我们还无法通过已学的知识从物质类别角度对H2O2性质进行预测,可以另辟蹊径:在学习氧化还原反应后我们认识了氧化剂和还原剂,请从元素价态的角度,结合学案对H2O2的性质进行分析。
[生2] H2O2中氧元素显示-1价,-1价的氧元素化合价可以降低转化为-2价;化合价降低,被还原,发生还原反应;所以,H2O2应该具有氧化性,可做氧化剂,还原产物是H2O。H2O2中氧元素的-1价还可以转化为0价,化合价升高,被氧化,发生氧化反应。所以,H2O2应该具有还原性,可做还原剂,氧化产物是O2。
[教师] 研究某种物质具有氧化性能做氧化剂时需要加入具有还原性的物质做还原剂,才能发生氧化还原反应。反之,则相反。明确了氧化还原原理,现在我们就要根据预期所可能产生的实验现象,分别设计合理的实验方案来验证预测产物。请从小组给定的实验药品中选择合适的试剂或药品来设计实验步骤,以证实预测,先设计探究过氧化氢的氧化性的实验步骤。
[生3] 将过氧化氢溶液滴在淀粉-KI试纸上,如果出现试纸变蓝的现象,说明有碘单质产生,
说明过氧化氢将KI中的I-氧化成I2,过氧化氢具有氧化性。
[教师] 好!淀粉-KI试纸也可以是在无色的KI溶液和酸(如:盐酸)的混合溶液中滴加H2O2溶液,当溶液变为黄色或棕色后,再滴加淀粉溶液后溶液变为蓝色。(教师演示此实验)
(教学课件截图3)
[教师] 这里的酸性环境是反应的介质,可以加快反应速率。请大家完成此探究实验,时间2分钟之内,完成以后组内同学复原坐好。
[学生分组1] 探究过氧化氢的氧化性
实验步骤:将3%过氧化氢溶液滴加3-4滴到淀粉-KI试纸上,观察现象。
实验现象:淀粉-KI试纸变蓝(见图2)
[教师] 谁再来设计验证H2O2还原性的实验方案?
[生4] 选择氧化剂高锰酸钾,与H2O2反应,观察是否产生使带火星木条复燃的氧气。
[教师] 要验证氧气必须氧气浓度较大,我们使用淘宝上售卖的高锰酸钾片和3%过氧化氢溶液反应,请开始分组实验,时间3分钟,完毕后自主复原做好。
[学生分组] 探究过氧化氢的还原性
实验步骤:在酸性KMnO4溶液中滴加3%过氧化氢溶液,用带火星木条检验产生气体。
实验现象与原理:紫红色KMnO4溶液褪色,产生较多无色气泡,该气体能使带火星木条复燃。
[教师] 为确保验证是否有氧气产生,我们需要较多的高锰酸钾,则KMnO4溶液褪色现象这里不明显。当其浓度较小时,加入较高浓度H2O2溶液,则褪色现象明显。
(教学课件截图4)
[教师] 小结基于元素价态探究物质性质的认知模型
(教学课件截图5)
[教师] SO2属于非金属氧化物,绝大多数非金属氧化物属于酸性氧化物,所以SO2应该具有酸性氧化物的通性,能与水、碱、碱性氧化物反应。类比典型酸性氧化物CO2,可写出少量SO2与足量NaOH溶液反应的相关方程式
[生5] SO2+2NaOH=Na2SO3+H2O
SO2+H2O=H2SO3
SO2+CaO═(高温)CaSO3
[教师] 实验室制取SO2的反应为Na2SO3+H2SO4(较浓)= Na2SO4+SO2↑+H2O。
[生6] 实验药品:紫色石蕊溶液、NaOH溶液、酚酞溶液
实验步骤与现象(1)将收集满SO2的注射器伸入水槽中得到二氧化硫水溶液,在二氧化硫水溶液中滴入紫色石蕊溶液,溶液变红。(2)向滴有酚酞的NaOH溶液中滴入二氧化硫水溶液,溶液由红色变成无色。
查阅资料:生石灰氧化钙可以吸收烟气中的SO2
实验结论:SO2属于酸性氧化物,具有酸性氧化物的性质。
[教师] 由以上分析可以看出,我们能从物质分类、氧化还原的角度预测物质的性质,并通过实验进行验证,知道了物质的性质就可以实现物质间的转化,化学反应中不仅有物质类别的转化,也有物质所含元素不同价态的转化。所以,我们在分析物质的转化时,可以同时关注这两个角度。利用物质间的转化来制备生产中需要的产品,实现物质性质的真正应用,实现化学学科价值。接下来我们就完成一个实际任务:
[教师] 硫酸铜具有改善水质、配制农药波尔多液、做纺织品媒染剂等广泛应用,工业上常将废铜转化为硫酸铜,如何实现设计转化方案,将金属Cu经一步反应转化为CuSO4?铜与稀硫酸反应可以吗?
[生7] 不可以,金属铜排在氢后,是不活泼金属,还原性较弱,不能与稀硫酸反应,此方案不可行。
[教师] 核心元素铜元素的价态由0价升高到+2价,被氧化,需要引入氧化剂,可加入酸性H2O2溶液,几分钟后无色溶液逐渐变成蓝色,说明有硫酸铜产生。
(教学课件截图6)
请将上述反应改写为离子方程式,可得到如下结果:Cu+2H++H2O2=Cu2++2H2O
为加快反应速率,我们可以使用铜粉,现象如左图所示。科学家在研究物质的转化方案时关注的角度和我们的学习是一样的,不过,在实际生产中还要综合考虑原料成本、能耗、环保、安全等综合因素。
[师生互动1] 在此反应中金属铜是还原剂,H2O2是氧化剂,H2SO4是反应介质,既不做氧化剂也不做还原剂。H2O2能在常温下把铜单质这种还原剂氧化为Cu2+,而稀硫酸或稀盐酸这样的氧化剂却不能氧化铜单质,由此,你能悟到什么?
[生7] ①不同的氧化剂氧化能力不同;②相同的还原剂遇到不同氧化剂,反应结果不同;
③氧化性:H2O2>稀硫酸(稀盐酸)。
[师生互动2] 在今天课上使用的物质中,金属铜能与KMnO4溶液发生氧化还原反应吗?
酸性高锰酸钾溶液能使淀粉-KI试纸变蓝吗?答案是肯定的。课下同学们有兴趣可以继续实验探究。由此可见,典型的氧化剂与典型的还原剂在一定条件下均可以发生氧化还原反应。
5、教学反思与评价
本节高中化学复习课摒弃了机械罗列知识点和单纯练习题目的教学设计,通过真实情境下的问题解决,应用物质分类与氧化还原反应的工具性知识,实现对学生学科素养的培养。提出的问题与学生的初中所学存在认知冲突,旨在激发学习兴趣和参与度;设计的探究实验原料易得、操作简便、现象明显、条件常温,成功率高演示效果良好,实现学生的认知从感性到理性、从证据推理到模型认知、从实验事实到符号表征多个维度的有效融合。体现教、学、评一体化。导学案设计、体现了学生课堂学习的结果性评价,评价性问题来自真实的学习反馈,如:有学生把小苏打受热分解的产物CO2错误书写为O2,或把小苏打受热分解的产物错误书写为CO2和KOH;错误的原因在于没有实现从物质性质角度理解物质的分类CO2是酸性氧化物,不能与KOH这样的碱类物质共存,还在于没有深入理解氧化还原反应的实质是化合价有升必有降,升降守恒的黄金原则,所出现的方程式书写错误只有化合价降低没有化合价升高。提升复习课的教学质量需要教师在充分了解学情、精心备课,紧扣化学核心素养,为学生设计挑战性学习任务,在复习课上使学生的关键能力能以提升。如何更有效地落实教、学、评一体化笔者将在今后的教学中不断探索和实践。
参考文献
[1]中华人民共和国教育部.普通高中化学课程标准(2017年版2020年修订)[S].北京:人民教育出版社,2020:74-79.
[2]惠大超. 基于“教、学、评”一体化的“三单导学”教学探索---以“碳酸钠的性质与应用”为例[J]. 中学化学教学参考,2019,(6):29-33.
[3]申燕,程俊,柳先美,尹红. 基于“教、学、评”一体化理念的高中化学教学实施---以“铁盐和亚铁盐”的两节省级优质课为例[J]. 化学教学,2022,(1): 38-43.
[4]陈晓燕,卢天宇. 基于“教、学、评”一体化的深度学习---以“气压变化在化学实验中的应用”复习课为例[J]. 化学教育,2021,(13): 41-46.







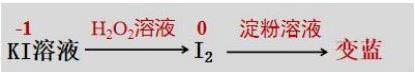




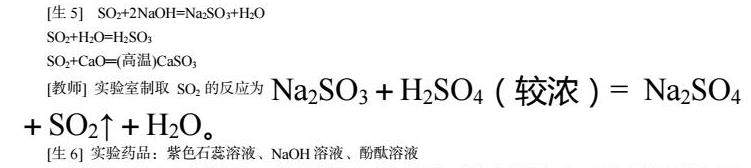

 京公网安备 11011302003690号
京公网安备 11011302003690号


