
- 收藏
- 加入书签
基于影像组学和人工智能的肿瘤个体化治疗策略
作者简介:(1991.7.8—)女,汉族,山西运城,山西大同大学,护理学,本科主管护师,医学类护理心理摘要:肿瘤的高度异质性是精准治疗的主要挑战。影像组学从医学图像中提取定量特征,与人工智能(AI)相结合,为肿瘤诊疗提供了新方法。本文综述了基于影像组学与AI 的个体化治疗策略,梳理了从机器学习到深度学习、Transformer 模型的技术发展,并重点探讨了其在预测分子特征、评估疗效、监测治疗反应及辅助手术与放疗规划等方面的临床作用。结合多癌种研究数据,AI 模型在预测基因突变和治疗应答中表现出较高效能(如 AUC 可达 0.82-0.97)。尽管面临数据标准化与模型可解释性等挑战,但通过构建可信 AI、利用公共数据库及开展前瞻性试验,该策略有望推动肿瘤诊疗向“数字孪生”与精准干预时代迈进。关键词:影像组学;人工智能;精准肿瘤学;个体化治疗;深度学习;疗效预测
一、引言
肿瘤的高度时空异质性是导致治疗反应不一和耐药性的核心原因,也是个体化精准治疗面临的根本障碍。传统的组织活检具有侵入性,且难以全面反映肿瘤的整体异质性。在此背景下,医学影像作为临床常规、无创并能全局反映肿瘤表型的工具,其价值亟待深度挖掘。影像组学(Radiomics)应运而生,它通过高通量提取CT、MRI、PET 等图像中的海量定量特征(如纹理、形状、小波特征),将影像转化为可深度分析的“数据宝库”[1]。与此同时,人工智能(AI)和深度学习技术快速发展,为从高维、复杂的影像组学数据中找出与肿瘤生物学行为、治疗敏感性预后相关的隐藏模式提供前所未有的能力,二者的结合使通过无创影像“看透”肿瘤内在分子特性、动态评估治疗反应成为可能,正推动肿瘤诊疗从“一刀切”模式向“量体裁衣”的个体化范式革命性转变。
二、影像组学迈向多模态AI 集成
技术的迭代是驱动该领域发展的核心引擎。其演进路径可概括为从传统影像组学到深度学习,再到多模态融合的复杂系统。
图 1 影像组学与人工智能技术演进路径
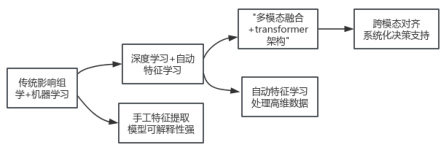
2.1 传统影像组学与机器学习
传统影像组学分析通常遵循一个标准流程:图像获取与标准化预处理、肿瘤区域勾画(分割)、高通量特征提取、特征筛选与降维,然后利用机器学习模型(如随机森林、支持向量机等)构建预测模型。方法的关键在于“手工设计”的特征,其优势在于模型相对可解释,且适用于中等规模数据集。
2.2 深度学习与自动化特征学习
深度学习(如卷积神经网络 CNN)突破了手工特征的限制,能够直接从原始图像中自动学习层次化的高级特征。这不仅省去了复杂的特征工程,而且往往能发现人眼无法识别的新模式。例如,在急性髓系白血病(AML)的诊断中,深度学习平台对骨髓细胞影像识别的受试者工作特征曲线下面积(AUC)可达 0.97,展现出极高的鉴别能力[2]。
2.3 多模态融合与前沿架构
当前的研究前沿集中于多模态数据融合,这不仅是要整合不同的影像序列,而且要结合影像组学、基因组学、病理组学以及临床信息等多维度数据,这样才能构建更全面的患者“数字画像”。因此,如 Transformer 等新型架构,因其强大的长距离依赖建模与跨模态对齐能力而备受青睐。基于这些技术,AI 模型正在从单一任务预测工具,进化为整合多源信息、支持多环节临床决策的复杂系统。例如,研究者已提出基于AI 的AML 临床决策支持系统概念,可自动整合临床、形态学及基因型数据,生成个体化治疗建议。
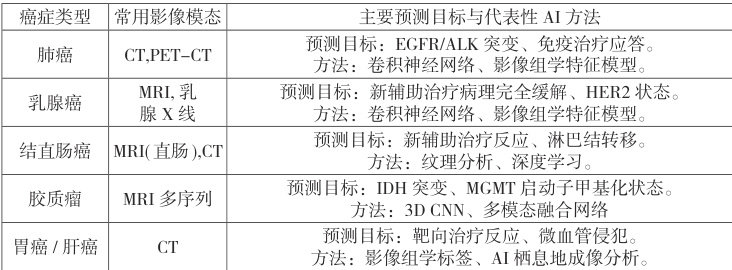
为了更直观地展示 AI 模型在泛癌种靶向治疗预测中的应用广度与效能,以下图表汇总了基于近期大规模综述研究的数据。
表1 基于影像的AI 模型预测泛癌种靶向治疗反应的代表性应用
三、临床应用:贯穿诊疗全周期的个体化策略
基于影像组学 -AI 的策略已渗透至肿瘤诊疗的多个关键环节,其核心价值在于实现决策的“前移”和“精准化”。
3.1 治疗前无创预测
在治疗开始前,利用基线影像无创预测肿瘤的关键分子特征,能规避有创活检的局限性和采样误差。在非小细胞肺癌中,AI 模型通过分析术前 CT 影像,预测其 EGFR 突变或 ALK 融合状态,为靶向治疗提供影像学依据 [3]。在 AML 中,机器学习与深度学习模型通过整合多维度的临床、细胞形态学、细胞遗传学及分子数据,显著提升预后风险分层的精确性,并增强基因变异预测的潜力。研究表明,此类 AI 工具有望克服传统方法的局限性,不仅有助于快速筛选潜在获益人群,更能为无法获取组织样本的患者提供重要的治疗决策线索。
3.2 疗效预测与评估
在新辅助治疗时,在直肠癌、乳腺癌等新辅助治疗的患者中,提前预测其是否能够达到病理完全缓解(pCR),这对于制定“等待观察”等保器官策略至关重要。基于治疗前 MRI 的影像组学模型在此方面展现出巨大潜力,在免疫治疗时代,AI 模型通过分析基线和早期随访影像,能够早期区分应答者与非应答者,有效鉴别由免疫细胞浸润引起的“假性进展”与由肿瘤生长导致的真进展,避免患者过早终止有效治疗。
3.3 预后评估与复发监测
AI 模型通过深度挖掘治疗前影像中包含的预后信息,为实现个体化的预后评估和复发监测提供新途径。在血液肿瘤领域,基于可解释 AI 框架的模型已能实现急性髓系白血病细胞的高精度识别与风险分层。在实体瘤中,研究同样证实了其有效性:例如,基于 CT 的影像组学模型预测非小细胞肺癌患者 ⩽3 年生存期的AUC 可达0.77 以上;而融合影像组学与临床因素的列线图模型,在预测结直肠癌肿瘤沉积与无复发生存期时,AUC 可达到0.85。高精度的预测能力,可为临床早期识别高危患者、制定差异化的辅助治疗与随访策略提供客观、量化的决策支持。
四、系统集成与实施路径
影像组学与 AI 策略的临床价值得以实现,不仅依赖于算法模型的先进性,而且也取决于与现有医疗系统的深度融合和标准化实施。本章节探讨从单点技术验证到系统性临床整合的关键路径。
4.1 模型转化与临床决策系统构建
AI 模型转化为可用的临床工具,需要构建完整的临床决策支持系统(CDSS),这包括:前端交互界面,为放射科、肿瘤科医生提供直观的可视化报告与风险评分;后端分析引擎以及医院信息系统接口。例如,已在试点中应用的 AML 智能诊断系统,可自动从骨髓涂片影像中识别异常细胞,并将结构化报告直接推送至病理医生工作站,将分析时间从传统数小时缩短至分钟级。
4.2 标准化分析流程与质控体系
为确保不同医疗机构间结果的可比性与可重复性,需建立标准化的影像组学分析流程,涵盖从图像采集、病灶分割(结合 AI 自动分割和医生审核)、特征提取到模型推断的整个流程。在肿瘤影像组学研究中,只有遵循标准化的全链条分析步骤,才能确保模型的诊断效果、可重复性以及跨中心泛化能力 [4]。同时,必须建立相应的质量控制机制,包括定期用标准测试片检查影像设备的稳定性,并需持续监控与更新 AI 模型性能,才能防止因数据分布变化(如设备更新、人群差异)导致模型的预测性能下降。
4.3 多学科团队协作模式的重塑
影像组学 -AI 的应用本质上是数据驱动的精准医疗,它必然重塑传统的肿瘤诊疗工作模式[5]。未来需要建立以影像 - 病 - 临床基因组学 - 肿瘤内科 / 外科为核心的“数字肿瘤委员会”常态协作机制。AI 提供的量化预测结果将成为多学科讨论的客观依据,辅助制定更优的个体化治疗方案,并推动影像医生从“形态描述者”向“信息整合与决策参与者”的角色转型。
4.4 阶梯式临床验证与卫生经济学评估
技术的成熟与采纳需经历循序渐进的证据积累。建议采用三阶段验证路径:第一阶段在单中心数据中验证技术可行性并建立预测模型,例如,一项基于 DCE-MRI 影像组学预测胃癌肿瘤浸润淋巴细胞表达的研究,便是在此阶段构建并初步验证了模型的有效性[6] ;第二阶段在多中心环境中验证模型的鲁棒性与泛化能力;第三阶段在前瞻性随机试验中评估其对临床终点(如总生存期、生活质量)和卫生经济学指标(如成本 - 效果比)的实际影响,为大规模医保覆盖与政策支持提供终极证据。
五、挑战与展望
5.1 数据标准化瓶颈
影像组学特征对成像参数和设备的高度敏感性,是进行跨中心验证和临床推广的首要障碍。研究表明,不同扫描协议(例如 MRI 场强、CT 层厚)可能导致定量特征出现显著差异,这会直接削弱模型的泛化能力。要解决这个问题,需从标准化和校正两方面入手:一是在数据采集阶段,要广泛采用国际通用的影像获取与重建标准化协议,如 RSNA-QIBA,并使用专用模体进行定期质量控制,这样才能最小化源头的技术差异;二是在数据处理阶段,要开发和推广设备无关的特征校正算法,例如利用病灶与正常组织的特征比值或进行基于体模的校准转换,才提升特征的鲁棒性和可比性。
5.2 算法泛化性局限
当前多数研究基于单中心、小样本数据,导致模型在外部真实世界场景中性能下降。提升泛化性的根本途径在于利用多样化的大规模数据训练模型,这需要创新的数据协作范式:一方面,应推动建设国家级或区域性的多中心影像组学公共数据库,确保数据在癌种、分期、人种及设备类型上的代表性;另一方面,在数据难以集中共享的现实中,可采用联邦学习等隐私计算技术,构建分布式协作网络,让模型能在各机构加密的数据上共同训练和改进,只有这样才能在不转移原始数据的情况下,获得强大的适应能力。
5.3 临床转化壁垒
影像组学 -AI 产品迈向临床面临多重转化壁垒,核心在于模型的可解释性、临床效用的严谨证明以及合规的监管路径。首先,深度学习“黑箱”特性阻碍临床信任,需结合注意力机制、可解释性 AI 等方法,将模型决策依据可视化。其次,必须通过设计严谨的前瞻性、多中心临床试验来验证其能否真正改善患者预后或临床决策流程,这是获得监管批准(如 FDA、NMPA)的基石,相关研究已在直肠癌新辅助治疗反应预测中展现出模型与临床终点的关联潜力。最后,在转化过程中必须全面考量伦理与公平性,这包括:确保训练数据涵盖多样化的患者群体以避免算法偏见;严格保护患者隐私与数据安全;以及建立清晰的临床应用责任界定框架。唯有如此,才能负责任地推动该项创新技术的落地。
5.4 未来融合方向
未来的发展必须超越单一的影像分析,要走向更深度的多模态融合与动态系统集成,融合方向包括:纵向融合,即分析治疗前、中、后的影像动态变化,建模为“数字轨迹”,这样才能实现疗效的早期与持续预测;横向融合,要整合影像组学与基因组学、病理组学、液体活检临床文本等多维度数据,构建全面的患者“数字孪生”,用于模拟不同治疗策略的潜在结果。要实现这一愿景,需开发更强大的多模态融合架构 ( 如 Transformer),并建立支持安全数据协作与持续学习的生态系统,从而推动肿瘤诊疗迈入全周期、个体化的智能决策新时代。
六、结论
影像组学与人工智能的深度融合,正从根本上重塑肿瘤诊疗范式,使其从依赖群体经验的传统模式,向基于数据驱动的个体化精准模式转型。本文系统回顾了该领域从手工特征到深度学习,再向多模态融合演进的技术路径,并阐述了其在预测分子特征、评估治疗反应及预后等多个关键临床环节的应用价值与实证效能。
然而,要实现其广泛的临床转化,必须系统性地攻克三大核心挑战:数据异质性带来的泛化瓶颈、模型不可解释性引发的信任危机、以及临床验证与伦理监管体系的滞后,未来的发展路径应聚焦于:第一,依托标准化协议和隐私计算技术(如联邦学习)来构建高质量、跨中心的数据协作生态;第二,要致力于开发透明、可解释、公平的可信赖 AI 模型,通过前瞻性临床试验严格验证临床效用;第三,需同步构建与之适应的伦理审查框架和敏捷监管通道。
展望未来,通过持续深化多模态数据融合,构建患者“数字孪生”,并完成从技术验证到临床效益证明的闭环,基于影像组学与 AI 的策略有望成为肿瘤精准医疗的核心基础设施,最终提升患者的生存获益与生活质量。
参考文献
[1] 方孜 . 表观扩散系数及影像组学在胰腺囊性肿瘤的应用价值研究 [D]. 广州医科大学 ,2025.
[2] 朱超 . 基于 CTE 的影像组学和深度学习在克罗恩病鉴别诊断及预测粘膜愈合中的研究[D]. 安徽医科大学 ,2024.
[3] 彭泽飞 , 徐海 , 杨斌 .CT 深度学习及影像组学在非小细胞肺癌个体化治疗中的应用研究进展 [J]. 中国中西医结合影像学杂志 ,2024,22(06):746-751.
[4] 姜泽坤. 影像组学技术研究及临床肿瘤诊疗应用[D]. 山东师范大学,2021.
[5] 宋马小薇 . 基于影像组学模型预测直肠癌新辅助治疗肿瘤退缩分级 [D]. 北京大学医学部 ,2021.
[6] 黄慧贞 . 基于 DCE-MRI 影像组学模型预测胃癌肿瘤浸润淋巴细胞的表达 [D]. 绍兴文理学院 ,2024.






 京公网安备 11011302003690号
京公网安备 11011302003690号


