
- 收藏
- 加入书签
基于SEER数据库构建的成年人卵巢癌预后列线图
目的 构建成年人乳腺癌的有效预后列线图。方法 从SEER(The Surveillance, Epidemiology ,and End Results)数据库中筛选到2010年1月至2015年12月诊断为成人卵巢癌的4734例病人,应用Kaplan-Meier法绘制生存曲线,Log-rank检验并评价各因素不同亚组生存期的差别,使用Cox比例风险回归模型分析获取独立预后因素,采用R软件构建预后列线图,列线图的预测准确性和判别能力由C指数和校准曲线确定。结果 年龄≥60岁、黑人、非婚状态、病理组织分化II-IV级、粘液性癌、透明细胞癌、T2或T3分期、N1分期、骨转移、脑转移、肝转移、肺转移是成年人卵巢癌患者预后的独立危险因素,而卵巢癌单侧发病、术前血清CA125检测指标阴性、手术治疗和化疗是成年人卵巢癌患者预后的独立保护因素。生存概率的校准曲线显示出列线图预测良好的一致性,列线图预测生存的C指数为0.728。结论 该列线图可以为成年人卵巢癌患者提供较为准确的预后预测。
【关键词】卵巢癌; 列线图; 生存; SEER数据库; 预后
Abstract: Objective To construct and validate an effective prognostic nomogram for ovarian cancer in adults. Methods Based on SEER (The Surveillance, Epidemiology, and End Results) data, 4734 adult patients were diagnosed with ovarian cancer between January 2010 and December 2015. Log-rank test was used to examine the difference between survival rates of different subgroups of factors based on the Kaplan-Meier method. Prognostic factors were determined using a multivariate analysis of Cox. Nomograms were drawn with R software, and their predicted performance was verified by the calibration chart. C-index was calculated to determine the model's accuracy. Results Age≥ 60 years, black people, non-marital status, grades II-IV, mucinous carcinoma, clear cell carcinoma, T2 or T3 stage, N1 stage, metastases of bone,brain,liver or lung are independent risk factors. Unilateral sites,negative preoperative serum CA125,surgery,chemotherapy were independent protective factors. Calibration curves for predicting survival by nomogram compared well with prediction by nomogram. The C-index of the nomogram for predicting survival was 0.728. Conclusion The nomogram can provide more accurate prognosis prediction for adults with ovarian cancer.
[Key words] ovarian cancer; nomogram; survival; SEER data; prognosis
卵巢癌占所有女性恶性肿瘤的2.5%,由于其高复发率和低生存率,是美国女性癌症相关死亡的第五大常见原因[1]。2018年,美国约有14070人死于卵巢癌[2]。由于卵巢癌的症状不明确,目前没有有效的筛查方法,大多数患者在诊断时已处于晚期(III期和IV期)[3-4]。近年来,列线图已被证明是一种全面和可读的预测癌症患者生存终点的模型[5]。列线图将复杂的数学回归模型转化为可视化的图形,根据模型中对结果变量的影响程度,给各因素打分,直观地展示预测指标的影响程度[6-7]。基于非常有限的临床变量信息,如年龄、肿瘤数量、淋巴结状态、手术等,nomogram能够预测个体患者的预后,帮助临床医生为患者制定个体化治疗和随访策略。在本研究中,我们评估了成年人卵巢癌潜在的预后因素,并建立了卵巢癌中总生存(OS,overall survival)和癌症特异性生存(CSS,cancer-specific survival)的列线图,然后使用C指数、校准图来评估列线图的鉴别性、校准性和临床实用性。
1.资料与方法
1.1数据资料获取
使用SEER*stat软件(版本号8.4.0.1)从SEER数据库(1975至2018年)中提取数据,提取条件为“(1)发病部位:卵巢;(2)诊断年份:2010-2015年;(3)既往无肿瘤史,提取变量为“年龄、种族、婚姻状态、诊断年份、组织学分级、组织类型、肿瘤大小、病灶单双测情况、术前血清CA125水平、远处器官(骨、肺、脑、肝)转移、原发灶是否手术、是否化疗、是否放疗、生存时间、生存状态,第七版美国癌症联合委员会(AJCC)T分期和N分期”。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 纳入、排除标准
SEER数据库中,2010年1月至2015年12月确诊的卵巢癌患者共有12445例。本研究纳排标准:(1)纳入病理确诊为上皮性卵巢癌(ICD-O-3解剖学编码为C56.9-Ovary),排除非上皮性卵巢癌,尸检或仅有死亡报告病例患者(1674例);(2)纳入确诊时年龄18岁以上且随访信息完整,排除随访时间不完整、死因是其他情况或死亡状态未知的患者(43例);(3)纳入诊断年龄、种族、婚姻状况、组织学等级、第七版美国癌症联合委员会(American Joint Committee Cancer,AJCC)卵巢癌TNM分期、术前血清学CA125水平、手术及放化疗资料完整,排除以上信息不完整的患者(5994例)。最终共纳入4734例符合筛选标准的病例。
1.3 临床病例特征
提取患者年龄、诊断年份、种族、婚姻、病理组织学分级、病理组织学类型、T分期(AJCC 第7版)和N分期(AJCC 第7版)、肿瘤病灶单双侧情况、肿瘤大小、术前血清学CA125水平、远处器官(骨、脑、肝、肺)转移、手术、化疗、放疗、生存状态、生存时间的信息进行分析。将年龄分成≤59岁、60-74岁、≥75岁组;诊断年份分成2010-2012年、2013-2015年组;婚姻状况分为:已婚、未婚/离异/丧偶组、未知组;种族分成白人、黑人、其他种族和未知;肿瘤大小分为<2cm,2-5cm,>5cm;组织学类型按照2014年《WHO女性生殖器官肿瘤分类》分为浆液性癌、内膜样癌、粘液性癌、透明细胞癌和其他癌[8]。
1.4 统计学方法 应用R软件(版本号 4.2.1)对病例资料进行统计描述,采用Log-rank χ2检验进行单因素分析,将单因素分析中P<0.05的变量纳入Cox多因素回归分析,并绘制Kaplan-Meier生存曲线。整合所有Cox多因素分析的独立预后因素,使用R软件中的“rms”包和“survival”包绘制预测列线图[9-10]。对列线图的准确性通过一致性指数(concordance index, C指数)和校准曲线进行评估。C指数值越高代表预测越精准;通过Bootstrap法重复取样1000次自检绘制校准曲线图,校准度越好,列线图预测生存概率与实际生存概率的符合度越好,P<0.05为差异有统计学意义。
2 结果
2.1 患者流行病学特征
本研究共纳入4734例患者,18-59岁组占50.2%;种族以白种人为主,占82.0%;病理组织学分级以III级和IV级为主,分别占37.0%和37.8%;病理组织类型以浆液性癌为主,占55.9%;绝大部分患者术前血清CA125水平升高,占84.9%;绝大部分患者进行了化疗,占81.1%;几乎所有的患者都进行了手术治疗(近100%)。见表1.
2.2 Cox比例风险回归分析
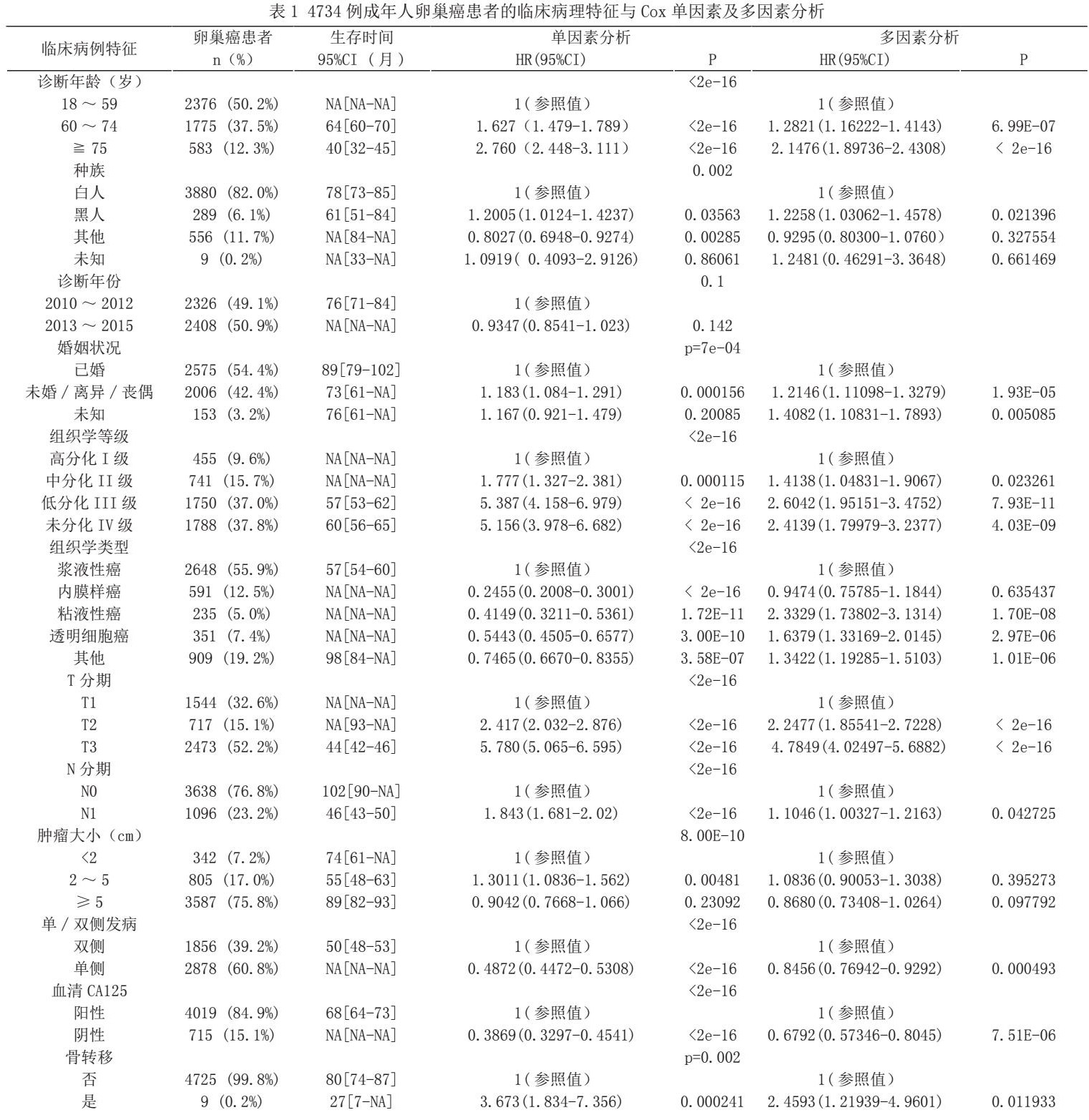
分析提示年龄、婚姻状态、种族、组织分化、组织类型、T分期、N分期、肿瘤大小、病灶单双侧情况,术前血清学CA125水平、远处器官(骨、脑、肝、肺)转移、手术、化疗是影响预后的独立危险因素(P<0.05)。其中相对18-59岁组,60-74岁组和75岁以上组是危险因素(P<0.05)。黑种人相对白种人是危险因素(P<0.05)。单身相对于结婚是危险因素(P<0.05)。病理分化II-IV级相对于I级是危险因素(P<0.05)。病理类型内膜样癌、粘液性癌和透明细胞癌相对于浆液性癌是危险因素(P<0.05)。T2、T3分期相对T1分期是危险因素(P<0.05)。N2分期相对于N1分期是危险因素(P<0.05)。肿瘤大小2-5cm组相对<2cm组是危险因素(P<0.05)。肿瘤单侧病灶相对双侧病灶是保护因素(P<0.05)。术前血清CA125水平阴性组相对于该指标阳性组是保护因素(P<0.05)。有远处器官(骨、脑、肝、肺)转移组相对于无远处器官转移组是危险因素(P<0.05)。手术治疗和放、化疗相对于未手术或化疗组是保护因素(P<0.05)。诊断年份和放疗与否与预后相关性差异无统计学意义(P>0.05).Cox单因素和多因素回归分析见表1,图1。
2.3 生存预后列线图的构建与验证
基于Cox比例风险回归分析绘制列线图,见图2。通过R软件构建可以个体化预测成年卵巢癌患者1、2、3年的癌症特异性生存率列线图。每个影响因素的不同亚型投射至分值标尺上即可得出每一项的分值,将每一项独立预后因素对应的分值相加得到总分,在总分标尺上向下画一条垂直线,即可得到患者1、2、3年的特异性生存率。总分值越高,患者预后越差。内部验证的C指数值为0.728,表明该模型的预测效果较好;列线图预测3年癌症特异性生存率的校准曲线靠近理想状况的灰色虚线,表明其预测生存状态与实际生存情况具有较高的一致性。见图3。
3 讨论
2020年中国卵巢癌的新发病例数已经超过5.5万例,其中70%的患者确诊时已属晚期[11]。虽然近年来靶向治疗和免疫治疗给卵巢癌的治疗带来了新的曙光,但患者的5年生存率仍不乐观,年死亡例数高达3.7万例[12]。由于临床医生经验性判断和TNM分期预测存在较大的局限性,不能快速、方便和准确的评估患者的预后,给临床医生随访管理和临床决策带来了一定困扰。列线图作为个体化、可视化的预后模型可以根据患者的临床特征评估患者的生存预后,准确度较高,利于临床决策,且已在肺癌、乳腺癌、肠癌等多种癌种应用[13]。此外,卵巢癌的随访研究不仅能早发现病情进展,并且能从中不断总结经验,完善诊治。SEER数据库作为北美最具有代表性的大型肿瘤登记注册数据库之一,涵盖了大约28%的美国人口的癌症治疗随访数据,该数据库中获得的研究数据代表了该人群的流行病学状况,在癌症的监测科学及收集、整理分析、解释基于人口的统计数据方面,具有样本量大、随访信息相对完整等优点[13]。因此,本研究基于SEER数据库,对成人卵巢癌的病例进行研究,确定了年龄、婚姻状态、种族、组织分化、组织类型、T分期、N分期、肿瘤大小、病灶单双侧情况,术前血清学CA125水平、远处器官(骨、脑、肝、肺)转移、手术、化疗是卵巢癌预后的独立预测因素。列线图的C指数值(0.728)和校准曲线显示了预测模型较好的准确性和临床适用性。
本研究的Cox多因素分析中发现,年龄>60岁,内膜样癌、粘液样癌、透明细胞癌,组织分化II-IV级,T2或T3分期,N1分期是预后独立危险因素。国内学者孙琳等发现,高龄是影响晚期原发性上皮性卵巢癌患者预后的独立危险因素(HR=1.83,P=0.001),与本研究结果基本一致[14]。上皮癌是卵巢癌最常见的组织学类型,5个主要亚型及其相对占比分别为:高级别浆液性癌(high-grade serous carcinoma, HGSC) 70%-80%,子宫内膜样癌10%,透明细胞癌10%,黏液癌3%,低级别浆液性癌(low-grade serous carcinoma, LGSC)不到5%[15],与本研究中各组织学类型的占比相似。子宫内膜样癌最常在疾病早期就可以确诊(与浆液性癌不同),往往对化疗相对敏感(与LGSC或透明细胞癌不同)。透明细胞癌被发现时常常是疾病早期(Ⅰ期或Ⅱ期),并且由于没有发生远处转移,预后相对较好。但透明细胞癌对铂类为基础化疗的敏感性不如其他组织学亚型的肿瘤[16],与本研究结果基本一致。
在本研究Cox多因素回归分析发现,肿瘤的组织分化较差、T分期或N分期较晚、肿瘤直径偏大、术前血清学CA125水平阳性、出现远处器官转移(骨、脑、肺、肝)转移的患者预后较差。卵巢癌肿瘤组织分化较差,肿瘤恶性表现越强,更容易出现转移等。T分期和N分期是肿瘤进展的重要分期,在本研究中T2或T3分期,N1分期提示预后的影响,在卵巢癌伴肺转移患者中出现相同结果[17],即分期越晚,预后越差。而肿瘤直径偏大与术前血清学CA125水平阳性是提示机体肿瘤负荷较大的指标。当肿瘤负荷过大,机体消耗和肿瘤免疫受抑制较大,严重影响患者对治疗的响应和预后。IV期的卵巢癌出现远处器官转移最常见的器官是肝(57%)、肺(38%)、骨(4%)、脑(1%),此前的研究同样表明出现远处器官的转移患者预后偏差[18]。目前晚期卵巢癌的主要治疗手段为手术、以铂类为基础的化疗及靶向治疗等。在本研究中手术和化疗是预后的独立保护性因素。积极的初始手术治疗有一些潜在益处,特别是对于晚期疾病患者:(1)尽量减少疾病负担的情况下,术后全身性化疗效果可能最理想。(2)疾病相关症状,如腹痛、腹围增加、呼吸困难和早饱,与肿瘤负担有关;切除大块病灶可迅速缓解症状和改善生存质量。(3)卵巢肿瘤会产生多种细胞因子,其中至少部分因子具有免疫抑制作用(如IL-10、血管内皮生长因子)。切除较大肿瘤可改善或恢复宿主免疫力[19]。(4)初始手术可确保准确诊断,并可保证进一步检查肿瘤组织。此外也有研究表明,对IV期卵巢癌患者行新辅助化疗可能改善患者预后[20]。
在本研究中,我们构建了成年人卵巢癌生存预后的列线图,列线图通过内部验证和校准曲线评估性能,提示有较好的准确性,预测的癌症生存率和实际的癌症生存率具有较高的符合度。但本研究构建的模型仍有不足。该研究数据来源于SEER数据库中的白种人,需要多中心、大样本的中国人群的病例进一步验证,才能确保模型使用的可靠性。此外针对卵巢癌的化疗、手术、靶向治疗等具体方案不能获取,对模型预测预后的准确性产生了不可忽视的影响。
综上所述,年龄、婚姻状态、种族、组织分化、组织类型、T分期、N分期、肿瘤大小、病灶单双侧情况,术前血清学CA125水平、远处器官(骨、脑、肝、肺)转移、手术、化疗是影响预后的独立危险因素。基于以上因素建立的列线图能较为准确、直观地个体化、可视化预测成年人卵巢癌患者的生存率。
参考文献
[1] Torre LA,Trabert B,DeSantis CE, et al.Ovarian cancer statistics, 2018[J].CA Cancer J Clin,2018,68(4):284-296.
[2] Siegel RL,Miller KD,Jemal A.Cancer statistics, 2019[J].CA Cancer J Clin,2019,69(1):7-34.
[3] Weidle UH,Birzele F,Kollmorgen G, et al.Mechanisms and Targets Involved in Dissemination of Ovarian Cancer[J].Cancer Genomics Proteomics,2016,13(6):407-423.
[4] Jelovac D,Armstrong DK.Recent progress in the diagnosis and treatment of ovarian cancer[J].CA Cancer J Clin,2011,61(3):183-203.
[5] Moreau JT,Hankinson TC,Baillet S, et al.Individual-patient prediction of meningioma malignancy and survival using the Surveillance, Epidemiology, and End Results database[J].NPJ Digit Med,2020,3:12.
[6] Hu MD,Chen SH,Liu Y, et al.Development and validation of a nomogram to predict the prognosis of patients with squamous cell carcinoma of the bladder[J].Biosci Rep,2019,39(12).
[7] Park SY.Nomogram: An analogue tool to deliver digital knowledge[J].J Thorac Cardiovasc Surg,2018,155(4):1793.
[8] Peres LC,Cushing-Haugen KL,Köbel M, et al.Invasive Epithelial Ovarian Cancer Survival by Histotype and Disease Stage[J].J Natl Cancer Inst,2019,111(1):60-68.
[9] 杨梅,莫永泮,韩晓蓉,等.分子标记列线图模型建立及评估三阴性乳腺癌预后的研究[J].中华肿瘤防治杂志,2016,23(15):8.
[10] 陈志航,陈泽斌,周倩,等.预测肝癌肝切除术后肝衰竭的影像组学列线图模型建立[J].中华肝脏外科手术学电子杂志,2019,8(2):6.
[11] 温灏.PARP抑制剂不良反应管理的中国专家共识(2021年版)[J].
[12] 饶玉梅,张微微,张颖,等.浆液性卵巢癌进展及预后关键分子的生物信息学筛选[J].郑州大学学报:医学版,2021.
[13] Jin C.,Cao J.,Cai Y., et al.A nomogram for predicting the risk of invasive pulmonary adenocarcinoma for patients with solitary peripheral subsolid nodules[J].Journal of Thoracic & Cardiovascular Surgery,2016:462.
[14] 孙琳. 晚期原发性上皮性卵巢癌治疗方式及预后相关因素分析[D] :山东大学.
[15] Heintz A P M,Odicino F.,Maisonneuve P., et al.Carcinoma of the fallopian tube. FIGO 26th Annual Report on the Results of Treatment in Gynecological Cancer[J].INTERNATIONAL JOURNAL OF GYNECOLOGY & OBSTETRICS,2006,95 Suppl 1:S145-160.
[16] Goff B. A.,Cuesta Rsdl,Muntz H. G., et al.Clear Cell Carcinoma of the Ovary: A Distinct Histologic Type with Poor Prognosis and Resistance to Platinum-Based Chemotherapy in Stage III Disease[J].GYNECOLOGIC ONCOLOGY,1996,60(3):412.
[17] Wang R.,Xie G.,Shang L., et al.Development and validation of nomograms for epithelial ovarian cancer: a SEER population-based, real-world study[J].Future Oncology,2021,17(8).
[18] Mcgonigle Kathryn F.,Lagasse Leo D.,Karlan Beth Y.Ovarian, Uterine, and Cervical Cancer in the Elderly Woman[J].CLINICS IN GERIATRIC MEDICINE,1993,9(1):115-130.
[19] Merogi A. J.,Marrogi A. J.,Ramesh R., et al.Tumor-host interaction: Analysis of cypokines, growth factors and tumor infiltrating lymphocytes in ovarian carcinomas[J].1996.
[20] Rauh-Hain J. A.,Melamed A.,Wright A., et al.Overall Survival Following Neoadjuvant Chemotherapy vs Primary Cytoreductive Surgery in Women With Epithelial Ovarian Cancer: Analysis of the National Cancer Database[J].JAMA Oncology,2017,3(1):76.






 京公网安备 11011302003690号
京公网安备 11011302003690号


