
- 收藏
- 加入书签
尼古丁的微生物代谢研究进展
摘要:本文综述了国内外关于尼古丁降解微生物的研究进展,包括降解尼古丁的微生物种类和代谢途径:吡啶途径、吡咯途径、脱甲基化途径以及吡啶途径与吡咯途径的混合途径,并阐明微生物降解尼古丁的研究意义,旨在为微生物降解尼古丁的进一步研究和应用提供参考。
关键词:尼古丁,微生物降解,代谢途径
中图分类号:Q939
烟草原产于美洲,大约在明朝时期,由吕宋岛(菲律宾)传到了福建沿海地区。随着时间的推移,人们的吸烟方式从最初的未加工烟草逐渐演变为吸食卷烟型烟草,进而发展到使用带滤嘴的卷烟。如今,全球至少有四分之一的人口喜欢吸烟,使得卷烟成为流行的商品。然而,在烟草制品的制备过程中,会有大量的尼古丁排放到环境中[1]。此外,烟蒂、电子烟滤嘴以及吸烟产生的烟雾同样会释放尼古丁到环境中。因此,如何高效且环保地处理烟草制品生产中积累的尼古丁,已经成为了学术界广泛关注的焦点。
尼古丁的降解方法包括物理法、化学法和生物法。物理法主要有吸附法和萃取法;化学法通常利用强氧化剂改变尼古丁的官能团或化学键的性质来降解尼古丁;而生物法是利用微生物对尼古丁的降解能力,从而消除环境中的尼古丁污染。相较于生物法,物理和化学方法更耗时,且需要昂贵的设备、耗材,不仅复杂繁琐,而且会产生其他有毒的副产物[2]。因此,近年来越来越多的研究者致力于研究微生物降解尼古丁,并在其微生物降解途径及其应用方面取得了显著进展。本文综述了国内外关于尼古丁降解微生物、尼古丁降解代谢途径的研究进展。
1.不同微生物的尼古丁降解能力
早在20世纪20年代,Batham 就发现,土壤中的细菌可以将尼古丁降解,并转化为硝酸盐[3]。随后,一些研究人员又分别从烟草的叶子、种子以及烟草生长的土壤中分离出能耐受尼古丁的微生物,这些微生物绝大多数是细菌,还包括部分真菌、放线菌等,其主要种属及降解特性详见表1。在这些研究中,对细菌的研究较为深入,主要包括假单胞菌属、节杆菌属等[4]。此外,在已报道的可降解尼古丁的微生物中,应用最广泛的是假单胞菌属,其尼古丁耐受度和降解效率一般都高于其他属的菌株,且在降解过程中会产生很多具有高附加值的中间产物。
2.微生物的尼古丁代谢途径
不同的微生物具有不一样的尼古丁代谢途径。早在1942年,Burcherer就从烟叶中筛选得到三种微生物并分离到一种紫色的底物。关于尼古丁代谢途径的研究在20世纪50年代进入兴盛时期。1955年,Tabuchi研究了50株可降解尼古丁的菌株,对它们的代谢产物进行分析,发现了尼古丁的相关代谢产物,如:氧化尼古丁(Oxynicofine)、3-吡啶-甲基酮(3-pyridyl-methylketone)、N-氧化-3-琥珀酰吡啶(3-succinoly-pyridine-N-oxide)[26]。同年,Frankenburg等人发现菌株的代谢产物紫外吸收特性不同,推测出了两种尼古丁的代谢途径[27]。1959年,Hylin筛选得到菌株Arthrobacter nicotinophagum,发现该菌株在不同的生长状态下有着不一样的代谢途径:当细胞进入快速分裂的状态时,尼古丁首先代谢生成6-羟基尼古丁,最终通过脂肪酸的形式进入到能量循环,为细胞的生长提供能量;当细胞转入成熟期,尼古丁的代谢进入到另外一种途径,最开始生成了伪氧化尼古丁,最终得到产物6-羟基-3-琥珀酰吡啶(6-hydroxy-3-succinylpyridine)[28]。
截止目前,已初步阐明的尼古丁的微生物降解途径主要有四种:吡啶途径、吡咯途径、脱甲基化途径以及吡啶途径与吡咯途径的混合途径。
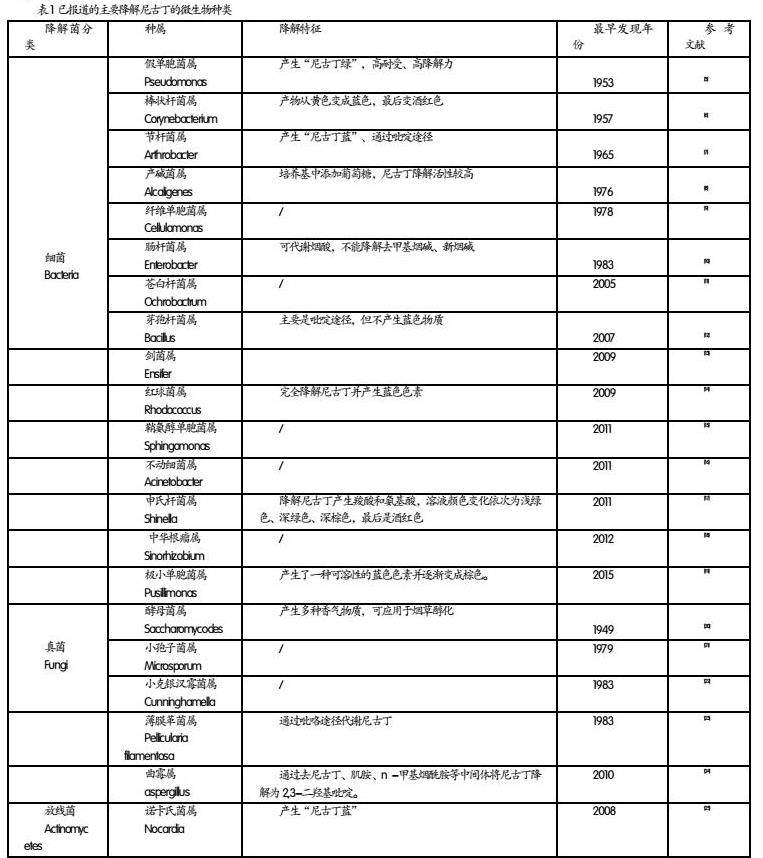
2.1 吡啶途径
由节杆菌属细菌Arthrobacter nicotinovorans pAOI的代谢途径总结得出[29],见图1。由图1可知,该途径包括以下步骤:(1)尼古丁脱氢酶直接作用于尼古丁的吡啶环,发生6位羟基化反应生成6-羟基尼古丁(6-hydroxynicotine,6-HN)。研究发现,Arthrobacter oxydans NRRL-B-3603降解尼古丁产生的6-HN,经过处理生成2,5-二羟基吡啶,最后进一步合成吡啶,吡啶是工业合成止痛药的重要先导化合物;(2)6-HN的吡咯环在6-羟基尼古丁氧化酶的作用下被氧化生成6-羟基-N-甲基麦喔斯明(6-hydroxy-N-methymyosmine,6-HMM),由于6-HMM的结构不稳定而发生自发性的水解,最后生成6-羟基假氧化尼古丁(6-hydroxy-pseudooxynicotine,6-HPON);(3)吡啶环进一步通过羟基化反应被打开生成2,6-二羟基假氧化尼古丁(2,6-dihydroxy pseudooxynicotine,DHPON);(4)2,6-二羟基假氧化尼古丁的侧链发生断裂,是代谢过程中的一个重要步骤,该物质在水解酶的催化下,反应生成2,6-二羟基吡啶(2,6-Dihydroxy-pyridine,2,6-DHP)和γ-甲基-胺基丁酸(γ-N-Methylaminobutyrate,GMAB)。(5)γ-甲基-胺基丁酸通过两种途径继续发生降解,一是胺氧化酶作用于侧链的氨甲基,使其直接脱掉后生成琥珀酸半醛(Succinic semialdehyde,SSA)。另一条途径是在酶的作用下使其先脱掉侧链的甲基生成γ-氨基丁酸(γ-aminobutyrate,GABA),再进一步脱掉裸露的氨基生成SSA。(6)SSA经过琥珀酸半醛脱氢酶的脱氢作用生成琥珀酸之后进入到三羧酸循环,为细胞代谢提供能量。微生物沿着该途径代谢尼古丁时,培养液中的颜色常出现变化,反应产生名为“尼古丁蓝”的物质。
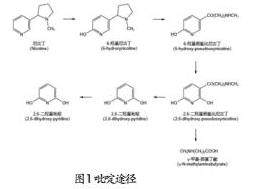
2.2 吡咯途径
主要存在于假单胞菌属的一种代谢途径,如Pseudomonas sp.41,Pseudomonas putida S16等。此外还有一些真菌,如棘孢小克汉霉属的Cechinulata echinulata IFO. 4444。如图2所示,该途径的具体步骤如下:(1)尼古丁的吡咯烷在酶的作用下,脱氢后生成N-甲基麦喔斯明(N-methymyosmine,NMM),此物质进一步因为不稳定而发生自发性的水解,生成假氧化尼古丁(Pseudooxynicotine,PN);(2)PN在尼古丁氧化还原酶的作用下脱去侧链的甲胺基,生成3-琥珀酰吡啶(3-succinoylpyridine,SP),吡咯烷被打开;(3)接着6位羟基化生成6-羟基-3-琥珀酰吡啶(6-hydroxy-3-succinoylpyridine,HSP);(4)HSP的侧链进一步断裂,生成2,5-二羟基吡啶(2,5-dihydroxypyridine,2,5-DHP);(5)2,5-DHP经过4步氧化开环断裂,先后生成N-甲基马来酰胺酸(N-Formylmaleamic acid,NFM),马来酰胺酸(Maleamic acid),顺丁烯二酸(Maleic acid)反丁烯二酸(Fumaric acid),最终进入三羧酸循环,完成代谢过程[30]。遵循该途径的尼古丁降解菌在降解高浓度的尼古丁时,通常会产生绿色的代谢产物,称为“尼古丁绿”。
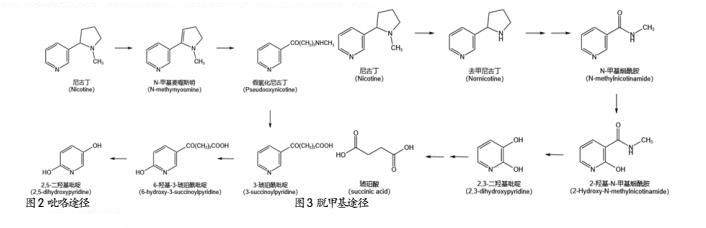
2.3 脱甲基化途径
主要存在于一些烟草植物和真菌中,如Aspergillus oryzoe 112822、Microsporum gypseum、Pellicularia filamentosa JTS. 208等。如图3所示,该途径是从尼古丁吡咯烷的脱甲基化开始,先生成去甲尼古丁(Nornicotine),再通过形成吡咯环的双键转化为麦斯明,随后吡咯烷裂解生成尚不明确的中间代谢产物,该中间代谢产物进一步被水解生成 N-甲基烟酰胺(N-methylnicotinamide)和乙酸。 N-甲基烟酰胺羟基化生成2-羟基-N-甲基烟酰胺(2-Hydroxy-N-methylnicotinamide),通过分解代谢生成2,3-二羟基吡啶(2,3-dihydroxypyridine,2,3-DHP),2,3-DHP 开环生成琥珀酸进入三羧酸循环[31].
2.4吡啶途径与吡咯途径的混合途径
随着对降解尼古丁微生物的深入研究,研究人员发现部分微生物降解尼古丁并非遵循单一代谢途径。其中已报道的Agrobacterium tumefaciens S33、Ochrobactrum sp. SJY1是通过吡啶与吡咯的混合途径降解尼古丁[32]。以Ochrobactrum sp. Strain SJY1为例,见图4。在SYJ1菌株中,尼古丁经由吡啶途径的前半部分先转化为6-羟基-尼古丁,6-羟基-尼古丁后经催化转化为6-羟基-N-甲基麦斯明,随后自发水解生成6-羟基假氧化尼古丁。至此,完成吡啶代谢途径。生成的中间代谢产物6-羟基假氧化尼古丁转化为4-(6-羟基吡啶)-4-氧代丁醛后,再经酶转化为6-羟基-3-琥珀酰吡啶,就进入与吡咯途径后半部分相同的阶段。6-羟基-3-琥珀酰吡啶在酶的催化作用下生成2,5-二羟基吡啶,该步是吡咯途径的关键步骤。随后2,5-二羟基吡啶打开吡啶环,再在脱甲酰酶的作用下生成顺丁烯酰胺酸,顺丁烯酰胺酸经去酰胺作用转化为顺丁烯,在顺丁烯二酸异构酶的作用下生成延胡索酸。
3 尼古丁微生物降解的研究意义
尼古丁作为烟草中的重要成分,对人的神经中枢具有刺激作用,是吸烟成瘾的重要原因。此外,尼古丁还具有强毒性,能够对种植地造成严重污染。因此,减少尼古丁带来的污染和危害极有必要。自然界中存在着许多可以降解尼古丁的微生物,充分利用这些微生物资源是保护生态环境、实现废物再利用的有效手段。
尼古丁降解微生物在农业、工业和科研领域也展现出巨大的潜力:从微生物代谢尼古丁的过程中筛选具有不同催化效率的生物催化剂,如提取尼古丁脱氢酶、6-羟基尼古丁氧化酶制成固定化酶,安放在空气过滤器内,对降低空气中的尼古丁含量具有显著效果。还可以利用高附加值的中间产物作为原材料或合成某些关键化学品的前体物质[33],如6-羟基-3-琥珀酰吡啶可以应用化学手段转化成5-氨基乙酰丙酸,5-氨基乙酰丙酸可以作为四吡咯结构卟啉的通用前体物质,而且还能够作为植物的生长激素、杀虫剂,甚至是诊断和治疗皮肤癌和口腔癌[34]。
通过生物手段处理尼古丁不仅高效,还能实现资源的循环利用和废物的价值转化,生产出有价值的化合物,展示了良好的应用前景。
参考文献
[1]Raman G, Mohan K, Manohar V, et al. Biodegradation of nicotine by a novel nicotine-degrading bacterium, Pseudomonas plecoglossicida TND35 and its new biotransformation intermediates[J]. Biodegradation, 2014, 25(1): 95-107.
[2]Huang XH, Song JJ, Li H, et al. Selective removal of nicotine from the main stream smoke by using a surface-imprinted polymer monolith as adsorbent[J]. J Hazard Mater, 2019, 365: 53-63.
[3]Batham HN. Nitrification in soils [J]. Soil Science, 1925, 20(5): 187-204.
[4]Eberhardt H. The biological degradation of nicotine by nicotinophilic microorganisms [J]. Beitriige zur Tabakforschung International, 2015, 16(3): 119-29.
[5]Wada E, Yamasaki K. Mechanism of microbial degradation of nicotine [J]. Science, 1953, 117(3033): 152-3.
[6]Giovannozzi SG. Arthrobacter nicotianae, a new type of bacterium causing nicotine degradation [J]. Coersta, 1959(3): 2595.
[7]Decker K, Bieeg H. Induction and purification of stereo specific nicotine oxidizing enzymes from Arthrobacter oxidans [J]. Biochim Biophys Acta (BBA), 1965, 105(2): 313-24.
[8]Uchida S, Maeda S, Masubuchi, et al. Isolation of nicotine-degrading bacteria and degradation of nicotine in shredded tobacco and tobacco extract [J]. Science Paper, 1976, 118: 197-201.
[9]Gravely LE, Geiss VL, Gregory CF. Process for reduction of nitrate and nicotine content of tobacco by microbial treatment: US, US 4557280A [P]. 1985.
[10]Gutierrez RV. Nicotine degradation by bacteria, Enterobacter cloacae as nicotine degrader [J]. Degrader (Spain), 1983, 22: 85-98.
[11]Yuan YJ, Lu ZX, Wu N, et al. Isolation and preliminary characterization of a novel nicotine-degrading bacterium, Ochrobactrum intermedium DN2 [J]. International Biodeterioration & Biodegradation, 2005, 56(1): 45-50.
[12]席宇, 宋淑红, 杨艳坤, 等. 微生物降解尼古丁的研究与应用进展 [J]. 河南农业科学, 2007, (3): 9-15.
[13]Lei LP, Zhang W, Wei HL, et al. Characterization of a novel nicotine-degrading Ensifer sp. strain N7 isolated from tobacco rhizosphere [J]. Ann Microbiol,2009,59 (2) : 247-52.
[14]Gong XW, Yang JK, Duan YQ, et al. Isolation and characterization of Rhodococcus sp. Y22 and its potential application to tobacco processing [J]. Res Microbiol, 2009,160(3) : 200-4.
[15]Wang MZ, Yang GQ, Wang X, et al. Nicotine degradation by two novel bacterial isolates of Acinetobacter sp. TW and Sphingomonas sp. TY and their responses in the presence of neonicotinoid insecticides [J]. World J Microbiol Biotechnol,2011, 27(7) : 1633-40.
[16]Li HJ,Duan YQ,Ma GH,et al. Isolation and characterization of Acinetobacter sp. ND12 capable of degrading nicotine [J]. Afr Microbiol Res,2011,5 (11) : 1335-41.
[17]Jiang HJ, Ma Y, Qiu GJ, et al. Biodegradation of nicotine by a novel Strain Shinella sp. HZN1 isolated from activated sludge [J]. J Environ Sci Health,2011, 46(8) : 703-8.
[18]陈晨, 麻广慧, 雷丽萍, 等. 尼古丁降解细菌 5-28 菌株的分离鉴定和降解特性 [J]. 烟草科技, 2012, 298( 5) : 74-8.
[19]Ma Y, Wen RT, Qiu JG, et al. Biodegradation of nicotine by a novel strain Pusillimonas [J]. Res Microbiol, 2015,166( 2) : 67-71.
[20]刘永亮, 王毅, 马永凯, 等. 微生物代谢尼古丁的研究及其应用 [J]. 基因组学与应用生物学, 2009, 28(4): 821-7.
[21]Sindelar RD, Rosazza JP, Barfknecht CF. N-Demethylation of nicotine and reduction of nicotine-1'-N-oxide by microsporum gypseum [J]. Applied & Environmental Microbiogy, 1979, 38(5): 836-9.
[22]UCHIDA S, MAEDA S, KISAKI T. Conversion of Nicotine into Nornicotine and N-Methylmyosmine by Fungi [J]. Agricultural & Biological Chemistry, 1983, 47(9): 1949-53.
[23] Uchida S, Maeda S, Kisaki T. Conversion of nicotine into nornicotine and N-methylmysomine by fungi [J]. Agric Biol Chem,1983,47(9) : 1949-1953.
[24]Meng X J,Lu L L,Gu G F,et al. A novel pathway for nicotine degradation by Aspergillus oryzae 112822 isolated from tobacco leaves [J]. Res Microbiol,2010, 161( 7) : 626-33.
[25]Ganas P, Sachelaru P, Mihasan M, et al. Two closely related pathways of nicotine catabolism in Arthrobacter nicotinovorans and Nocardioides sp. strain JS614 [J]. Archives of Microbiology, 2008, 189(5): 511.
[26]Tabuchi T. Microbial degradation of nicotine and nicotinic acid. I. Isolation of nicotine-decomposing bacteria and these morphological and physiological properties [J]. Journal of Japan Agricultural Chemistry Society, 1955, 28: 806-10.
[27]Frankenburg WG. Nicotine degradation in vitro induced by agents from tobacco seed [J]. Nature, 1955, 175(4465): 945.
[28]Hylin JW. The microbial degradation of nicotine II. The mode of action of Achromobacter nicotinophagum [J]. Archives of Biochem istry & Biophysics, 1959, 83(2): 528-37.
[29]Kachalova GS, Bourenkov GP, Mengesdorf T, et al. Crystal structure analysis of free and substrate-bound 6-hydroxy-L-nicotine oxidase from Arthrobacter nicotinovorans [J]. Journal of molecular biology, 2010, 396(3): 785-99.
[30]Tang H, Yao Y, Wang L, et al. Genomic analysis of Pseudomonas putida: genes in a genome island are crucial for nicotine degradation [J]. Scientific Reports, 2012, 2(4): 377.
[31]Lei L P,Zhang W,Wei H L,et al. Characterization of a novel nicotine-degrading Ensifer sp. strain N7 isolated from tobacco rhizosphere [J]. Ann Microbiol,2009,59 ( 2) : 247-52.
[32]Yu H,Tang H,Zhu X,et al. Molecular mechanism of nicotine degradation by a newly isolated strain Ochrobactrum sp. SJY1 [J]. Appl Environ Microbiol, 2015,81( 1) : 272-81.
[33]HENNINGFIELD JE, SLADE J. Tobacco-dependence medications: public health and regulatory issues [J]. Food and Drug Law Journal, 1998, 53(1): 75-114
[34]NAKANO H, WIESER M, HURH B, et al. Purification, characterization and gene cloning of 6-hydroxynicotinate 3-monooxygenase from Pseudomonas fluorescens TN5 [J]. European Journal of Biochemistry, 1999, 260(1): 120-6.
基金项目:“福建省中青年教师教育科研项目资助”(项目编号:JAT200946)
作者简介:王晓萍(1992-),女。研究方向:生物化学与分子生物学。






 京公网安备 11011302003690号
京公网安备 11011302003690号


