
- 收藏
- 加入书签
微生物法测定乳剂型特殊医学用途配方食品中B族维生素的影响因素
摘要:本文探讨了微生物法测定乳剂型特殊医学用途配方食品中B族维生素的影响因素,包括试样前处理、菌株活性、培养基品牌等。详细分析了维生素B12、泛酸、叶酸和生物素测定中的常见问题及解决方法,提出优化措施,以提高检测结果的准确性和稳定性。
关键词:微生物法;B族维生素;乳剂型特殊医学用途配方食品
1前言
B族维生素是一大类水溶性维生素总称,人体必需的B族维生素主要包括维生素B1(硫胺素)、维生素B2(核黄素)、维生素B3(烟酸/烟酰胺)、维生素B5(泛酸)、维生素B6(吡哆醇)、维生素B7(生物素)、维生素B9(叶酸)、维生素B12(氰钴胺),这些维生素在身体内发挥这各种重要的生理功能,它们在能量代谢、神经系统健康、细胞生成等多个方面发挥作用,对健康至关重要。
而特殊医学用途配方食品(foods for special medical purposes,FSMP)是为了满足进食受限、消化吸收障碍、代谢紊乱或特定疾病状态人群对营养素或膳食的特殊要求,专门加工配制而成的一类配方食品,该类食品必须在医生或临床营养师指导下,单独食用或与其他食品配合食用[1]。特医食品基质可以分为粉剂和乳剂,剂型不同会影响产品在体内吸收的速度和程度,导致对人体的刺激也不同。粉剂产品吸收的速度主要受到物料的溶出过程及跨膜转运过程的限制,基质跨膜转运吸收跟物料的分子质量、脂、水溶性、物料的浓度等有关,基质本身的理化性质如溶解度、分子质量等影响溶出,进而会影响到产品的吸收。乳剂不存在崩解、分散等过程,所以吸收相对较快,生物利用度要大于固粉剂,乳剂存在溶出过程,吸收比一般溶液剂慢,但是粒子越小,吸收也就越快。
乳剂型特殊医学用途配方食品组成包括蛋白质、脂肪、糖类、维生素、电解质、微量元素和水,属于典型的热力学不稳定乳液体系,其稳定性受配方中化合物组成、包装材料和储存环境等影响[2-3]。近几年特殊医学用途配方食品相关法规、标准和规范逐步发展完善[4-5],部分国内食品和药品企业开始致力于 FSMP 研发生产,正处于起步发展阶段[6-7]。FSMP 在加工及储存过程中在光、热、氧及包装材料等的影响下,容易发生美拉德反应、脂肪氧化、维生素化学性失活、衍生及物理性状失稳等现象,尤其是 FSMP 复杂体系中一些营养素的未知衍生物或化学反应产物存在安全隐患。对于热力学不稳定的乳剂型 FSMP,营养素失活失稳现象更加普遍[8-11]。B族维生素含量的添加量参考WS/T 578.5-2018《中国居民膳食营养素参考摄入量 第5部分:水溶性维生素》制定,因为乳剂型特殊医学用途配方食品组针对一些特殊人群如糖尿病、癌症和创伤患者提供营养和能量源维持机体的生命活动,所以添加量严格且微量。
微生物法测定维生素含量是活性菌株代谢试样中可被人体吸收利用的维生素,且检出限低、灵敏度高,测定结果准确可靠, 适用于微量维生素的含量测定。微生物法测定维生素含量的原理为在一定控制条件下,将对应的菌株菌液接种至含有被测定维生素试样液的培养基中,培养一段时间后测定透光率(或吸光度值),在一定测定范围内可以根据维生素含量与透光率(或吸光度值)的标准曲线计算出维生素含量。B族维生素中有维生素B3(烟酸/烟酰胺)、维生素B5(泛酸)、维生素B6(吡哆醇)、维生素B7(生物素)、维生素B9(叶酸)、维生素B12(氰钴胺)可以用微生物法测定其含量,在我国微生物法测定食品中的维生素B12、叶酸、泛酸、生物素是首选方法。
2微生物法测定维生素影响因素分析
微生物法测定维生素主要包括以下六个步骤:接种液的制备、试样前处理、标准系列管及试样系列管的制作、高压灭菌、接种及培养、数据测定及分析,其中对结果影响最大的有菌株活性及制备浓度、实验操作、培养基品牌等。
2.1试样前处理、标准系列管及试样系列管的制作
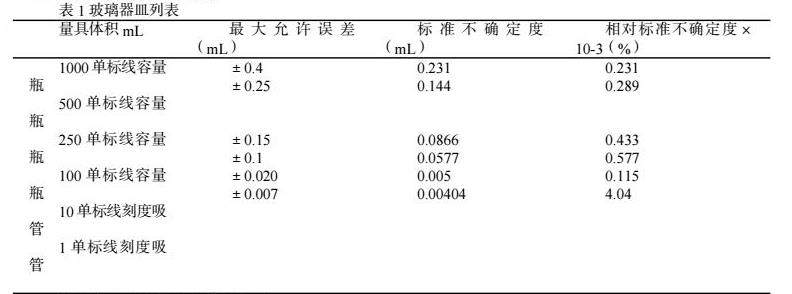
在日常操作过程中涉及到称量、定容、稀释、调PH值等基本操作。一些待测样中维生素含量的未知,初始量和稀释倍数很难确定,需要用多次实验去确认,而待测样的称样量和稀释的准确度关系到待测液系列管中维生素的含量是否在标准曲线范围内,直接影响检测结果;标准物质的称量、定容关系到标准曲线的拟合和维生素含量的计算;乳剂型特殊医学用途配方食品中维生素B12、叶酸、泛酸、生物素的测定中需要用到大量的玻璃器皿,(如表1),标准溶液配制定容和逐级稀释定容及移液操作对标准曲线的拟合起关键作用;而待测液的加样使用到10mL单标线刻度吸管或是已计量过的移液器的操作也会对结果造成关键影响,不同梯度的系列管少一滴多一滴直接影响到各个系列管的相对偏差,结果就会出现加大误差;其次玻璃器皿的洁净度会直接影响各管的偏差及数据的真实性。
2.2维生素B12测定问题及分析
维生素B12测定过程中用到的是ATCC 7830(莱士曼乳杆菌)或等效菌株CICC 6077(德氏乳杆菌乳酸亚种),在实际实验操作过程中不了解菌种特性产生的菌种失活,生长浓度过低或者功能退化等问题,从而影响检测的准确性和时效性,在使用过程中会不停的传代冻存,其生理状态可能会随着以上的操作导致变异或者活性减弱,导致标准曲线和待测样系列管吸光值变化不大,待测样维生素含量的结果不准确。
在样品前处理中乳剂型特殊医学用途配方食品高压水解后需调PH至4.5,维生素B12在PH值为4.5时释放最多,更能测出待测样真实结果;会有部分待测样在两次调PH后依然浑浊,可用0.22μm的滤膜再次进行过滤使待测样液清澈,或准备一支样品空白管,管内分别加入5mL待测样提取液和5mL待测样测定培养基,样品空白管吸光值要是大于0.02,需要减去每管其样品空白吸光值待测液体积的20%。
有些细菌是可以产生维生素B12,因此所有重复使用的玻璃器皿都要严格清洗,用去离子水清洗浸泡放入250℃干燥加热4个小时。
目前维生素B12测定培养基有北京陆桥、青岛海博、美国BD、HiMedia等品牌,其中北京陆桥培养基在煮沸冷却后样色较深、高压冷区后会浅一些,培养结束后颜色依然较深,产生的本底值较大,本底吸光值在0.2左右,会导致目标物质的促生长作用减弱,吸光度值没有等量增加,导致标准曲线线性结果不佳,高浓度点吸光值不成梯度变化趋势;青岛海博培养基同样也是存在本底值大的情况,本底吸光值在0.1左右;而美国BD和HiMedia培养基采购较为麻烦,货期长,价格贵,增加检测成本,其标准曲线线性结果理想。且在检验过程中,由于培养基中含有大量的糖类物质在高压灭菌过程中会发生美拉德反应导致培养基颜色加深,为减少每管之间的误差,所有待测样系列管高压结束迅速冰水浴冷却。
2.3泛酸测定问题及分析
泛酸测定标准与2024年3月6日正式更新使用GB 5009.210-2023,其中微生物法中样品前处理进行修改,将原GB 5009.210-2016标准中直接提取法中超声提取改为高压水解提取;原标准直接超声处理测定的泛酸结果往往偏高,可能存在的原因有乳剂型特殊医学用途配方食品超声处理后浑浊带有本底值;检测泛酸的ATCC 8014植物乳杆菌同时也测定生素和烟酸,在超声水解的过程中部分游离生物素和烟酸也被水解了,所以导致测定的泛酸值偏高。新标准中高压水解处理的样品测定结果偏低,可能是在乳剂型特殊医学用途配方食品加入10mL乙酸溶液(PH:4.5)立马形成絮状物,包裹部分泛酸在水解过程中未被释放;其次在加热水解和调节pH酸性时可能造成游离泛酸的分解而导致最终总泛酸结果有差异。
同时接菌液浓度和培养时间对泛酸的测定也有很大影响,标准要求菌浓度透光率范围在60% -80%,菌浓度越高培养时间过长会出现标准曲线高浓度点之间的吸光值变化区间不大,标准曲线平缓导致待测液各管之间的差异较大,还会出现断点的现象,超出标准准允许的最大误差。
2.4叶酸测定问题及分析
GB 5009.211-2022叶酸测定标准使用的菌株是ATCC 7469(鼠李糖乳杆菌),此菌株容易老化需要进行二次接种,且初次接种培养时间不超过20h后进行二次接种增加菌株活力的同时也可以消耗种子培养液中残存在菌株中的多余叶酸,制成的接种液需要用无菌0.9%的生理盐水清洗一次再直接作为接菌液使用,避免种子液中有残存的叶酸未代谢完。
乳剂型特殊医学用途配方食品样品用20%的氢氧化钠乙醇溶液超声3h处理后依然浑浊,可用0.22μm的滤膜再次进行过滤使待测样液清澈,或是取40mL样液于50mL离心管8000g10min,取上清液;样品处理中用到的乙醇纯度要求必须是用分析纯稀释至20%的浓度,低于此浓度提取效果不好,结果偏低。叶酸标准中间液使用的是20%氢氧化钠乙醇溶液用储备液100倍稀释至100mL容量瓶,反复开瓶使用乙醇溶液的挥发导致标准曲线梯度偏低,待测试样结果高,可用50mL棕色蓝盖瓶分装使用。
目前叶酸测定培养基有北京陆桥、青岛海博、美国BD、HiMedia等品牌,其中陆桥培养基培养的标准曲线吸光度值没有等量增加,导致标准曲线线性结果不佳,高浓度点吸光值不成梯度变化趋势。
2.5生物素测定问题及分析
GB 5009.259-2023(第二法)微生物法测生物素含量标准中使用的菌株是ATCC 8014(植物乳杆菌),接种液制备方式复杂,耗时长,一个月内多次传代菌株活力不稳定,易受外部因素干扰的诸多问题,实验菌株是维生素检测实验的关键,如此制备菌悬液容易导致每次试验稳定性不可控,会导致结果忽高忽低;原始储备菌株冻存时间不宜过长,新到菌株也应当根据菌株活力调整菌悬液浓度及培养时间。
目前生物素测定培养基有北京陆桥、青岛海博、美国BD等品牌,其中陆桥和海博培养基本底值高,标准曲线低浓度吸光度值涨势过高,高浓度点吸光值不成梯度变化趋势,导致标准曲线线性结果不佳。
3结论与讨论
样品特性,乳剂型特殊医学用途配方食品多为液体,其本身维生素含量较低,此类样品在常温静置状态存放时间长可能会出现油脂分层,样品不均匀的现象,导致多次数据差异大,可在每次做样前用振荡器将样品以250r/30min振荡混匀;样品前处理后样品处理液是浑浊,在测定样品时会带入部分本底值,导致结果偏高,可用过滤或离心的方式使其澄清。
菌株是维生素检测关键因素,不管是传代次数、存放时间以及菌悬液浓度是影响试验稳定性不可控的关键点。实验操作中可以将实验中用到的菌株按标准的方法制备好菌悬液,与甘油(80%)混合分装多支于-80℃冰箱冻存于2mL无菌冻存管中,利用甘油有效保护冷冻的菌株,达到了制备一次菌液可多次使用的目的,也保证实验数据的稳定性。
不同培养基对实验数据的影响因素,高压结束后未及时冷却导致的本底值高,样品吸光值变化不明显,各个品牌培养基对不同维生素项目的影响不同,应根据实际实验情况选择合适的培养基。
参考文献:
[1] 中华人民共和国国家卫生和计划生育委员会 . 食品安全国家标准特殊医学用途配方食品通则:GB 29922—2013[S]. 北京:中国标准出版社,2013.
[2] 石汉平 . 普通外科营养学[M]. 北京:人民军医出版社,2012.
[3] 陆冰怡,刘宝林,刘志东,等 . 食品罐头包装材料研究进展[J]. 包装与食品机械,2021,39(4):46-51.
[4] NILESH M R,VILAS P A,AMBADAS J S,et al.Formulation development of enteral nutrition products[J].International Research Journal of Pharmacy,2011,2(3):195-196.
[5] 韩军花 . 中国特殊医学用途配方食品标准法规——现状及展望[J]. 营养学报,2017,39(6):543-548.
[6] 陈斌,董海胜,张国文,等 . 特殊医学用途配方食品及其应用研究[J]. 食品科学技术学报,2017,35(1):6-16.
[7] 王星 . 关于特殊医学用途配方食品研发的几点思考[J]. 中国食物与营养,2017,23(4):8-10.
[8] 陈斌,董海胜,臧鹏,等 . 特殊医学用途配方食品生产工艺研究现状及展望[J]. 食品科学技术学报,2018,36(5):1-8.
[9] JB O,SA M,J S.Issues involved in the process of developing a medical food[J].Jpen Journal of Parenteral & Enteral Nutrition,2011,35(S5):73-79.
[10] Boschin G,Agostina A D,Rinaldi A,et al.Lysinoalanine content of formulas for enteral nutrition[J].J Dairy Sci,2003,86(7):2283-2287.
[11]TAKATORI S,OKAMOTO Y,KITAGAWA Y,et al.Simulated neonatal exposure to DEHP and MEHP from PVC enteral nutrition products[J].InternationalJournal of Pharmaceutics,2008,352(1-2):139-145.
作者简介:
罗奎莉(1996.08-),女,汉族,江苏南京人,本科,研究方向:食品检测研究。






 京公网安备 11011302003690号
京公网安备 11011302003690号


