
- 收藏
- 加入书签
一种基于注意力机制的深度学习方法用于宫颈癌调强放射治疗剂量预测的研究
摘要:目的:本研究旨在使用深度学习方法开发一个准确的预测模型,以预测宫颈癌的调强放射治疗(IMRT)剂量。方法:本研究方法采用3D Res-AUNet结合损失函数进行剂量预测。评估预测精准的的量化指标有两个:(1)对于全身体素,计算平均剂量差异、平均绝对误差(MAE)和不同等剂量体积的Dice相似系数(DSC)来评估全身剂量分布的准确性;(2)对于PTV,计算D99、D98、D50、D2、Dmean、均匀性指数和适形性指数,OAR则计算V48、V40和Dmean。采用配对样本t检验进行统计分析。结果:平均剂量差异范围为处方剂量的-1.86%至1.64%。30个测试集的平均MAE为(3.86 ± 1.10)%。30个测试集中不同等剂量线体积的平均DSC为0.947。临床剂量参数与预测剂量参数之间无显著统计学差异。结论:本研究成功开发并训练了一个具有注意力机制和结合损失函数的3D CNN模型,具有自动计划的临床应用潜力,助于IMRT计划的优化,最终改善宫颈癌患者的治疗效果和计划效率。
关键词:深度学习;3D剂量预测;IMRT;宫颈癌
引言
调强放射治疗是多种恶性肿瘤的有效治疗方案[1-3]。与三维适形放射治疗(3D-CRT)相比,IMRT在最大化处方剂量覆盖的同时,能够最大程度降低危及器官(OAR)受量,具有明显优势[4-7]。但设计IMRT计划可能是一个复杂且耗时的过程,尤其对于肿瘤较大且周围有有多个危及器官的情况[8,9]。此外,治疗计划的质量可能会因物理师的经验或治疗设施的不同而有很大差异,这会直接影响治疗效果[10,11]。
通常,设计治疗计划是一个逆向优化的过程,物理师根据放射肿瘤学指导原则、临床知识和医生的经验设定一系列超参数,并调整权重以平衡临床需求。然而,由于患者独特的解剖特征,有些临床需求可能无法实现,需要物理师微调参数以达到折衷的解决方案。物理师与医生之间的反复讨论和试验过程可能会大大延长治疗计划的时间[12]。因此,提前了解患者特定解剖结构的定量剂量学信息对于制定最佳治疗计划和提高治疗效率至关重要。
本研究提出了一种带有注意力机制的深度学习架构,能够自动聚焦于体内剂量差异。此外,我们开发了一个Combined_loss损失函数,根据体轮廓对身体不同部分赋予不同权重,从而更准确地反映体内剂量差异。
材料与方法
2.1 数据集收集
本研究包括了2016年至2020年在阜阳肿瘤医院放疗中心接受IMRT治疗的150例宫颈癌患者。这些IMRT计划由两名物理师采用类似的计划优化方法设计,使用Varian Eclipse Medical System(版本13.6)进行治疗,每个计划使用七野均分设计放疗计划。将150个病例被随机分为三部分:100例为训练数据,20例w为验证集,剩下的30例为测试。PTV的处方设定为200cGy/25次。OAR的分类包括膀胱、直肠、小肠、左股骨头(L)和右股骨头(R)。外部轮廓表示为身体。定位CT图像由Discovery CT590 RT机器获取,轴向切片厚度从2.5mm到5mm不等,分辨率为512x512像素,像素大小为0.82x0.82mm²和0.97x0.97mm²。
2.2 数据预处理
包括PTV和OAR轮廓的放射治疗结构(RT structure)以及CT图像和每个计划中的RT剂量数据均从治疗计划系统中导出。剂量矩阵和CT图像被重新采样为256×256像素,使用双线性插值方法。本研究将不同的编号标记OAR轮廓,以便根据不同OAR的临床剂量限值进行区分。膀胱、直肠、小肠和股骨头(左右)分别标记为数字3、5、7和9。PTV标记为数字11。模型输入使用了两个通道,分别包含RT结构通道和CT图像通道。所有相同深度的轮廓被合并,并作为模型输入的结构通道。CT图像灰度值被归一化到0到1之间。为了使剂量矩阵的数量级与CT图像相同,采用最大归一化方法即使用处方剂量的110%进行归一化,临床上描述为剂量热点。预测的剂量可以被逆向归一化为实际剂量。
模型工作流
图1展示了模型训练和预测的主要工作流程。考虑到空间剂量分布,包含患者全身CT切片和OAR的三维输入被送入模型。
模型架构
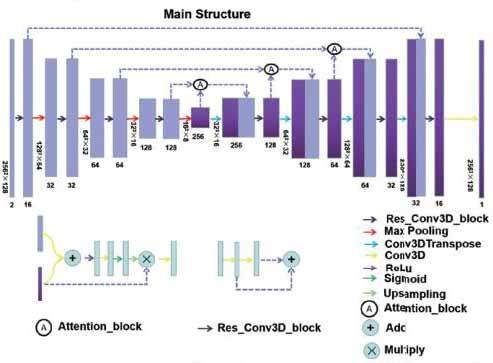
基本的卷积单元是Res_conv3D_block,它由两个串联的3x3x3卷积层组成。输出是这两个层的叠加,类似于ResNet中的残差块。在每次卷积之后,数据流进行归一化,并通过修正线性单元(ReLU)激活。在收缩路径中使用了四个Res_conv3D_block块,最后使用核尺寸为2x2x2的最大池化层进行下采样。
图2中的虚线箭头表示将收缩路径中的特征图从后层复制并重用,并与早期上采样层一起作为Attention_block的输入。Attention_block的输入经过不同内核和步幅的卷积,但与输入的早期上采样层具有相同尺寸。卷积层之和后接ReLU操作,之后使用一个1x1x1卷积并通过sigmoid函数激活。Upsampling3D层用于上采样,以保持与Attention_block的输入特征图相同的尺寸。Attention_block的输出特征图是输入特征图与上采样层输出的乘积,经过Res_conv3D_block后再与特征图进行拼接,并作为后续层的输入。
扩展路径中使用了三个Attention_block,随后使用conv3Dtranspose进行上采样。最后,使用一个核尺寸为1x1x1的卷积层,并通过ReLU激活,预测出最终剂量图。
图 2 上图展示了所提模型的主要架构。每个框代表特征图,框底部和左侧的数字分别对应于特征图的通道数和尺寸。Attention_block 模块如图中主结构下方所示。箭头表示不同的操作步骤和数据流向。
损失函数
临床剂量指标为真实值,均方误差(MSE)为损失函数。本研究提出一种改进的损失函数,Combined_loss。这种方法将输入分为两个部分,并在计算均方误差时对这些部分赋予不同的权重。
(
模型采用Adam优化器,Batch_size为1进行200个epoch的训练,学习率设定为0.0001。该3D Res-AUNet架构基于Keras以TensorFlow作为后端构建,并在一张16GB的Nvidia Tesla V100 GPU上进行训练。
预测评估
对于测试数据集中的每位患者,使用所提出的3D Res-AUNet模型来预测三维剂量图,并与临床值进行比较以定性评估准确性。计算每个体素位置的临床剂量()与预测剂量()的剂量差异(),然后计算全身体素的平均剂量差异及其标准差。平均绝对误差()也用于评估预测的准确性。为了评估临床剂量与预测剂量分布之间的一致性,我们将每位患者的OAR和PTV的剂量学参数与测试数据集中每位患者的临床参数进行了比较。OAR的选定剂量学参数为V48、V40(即OAR体积接收剂量为i Gy的百分比体积)和最大剂量(Dmax)。PTV的选定剂量学参数为D99、D98、D50、D2(即PTV体积的i%接收的剂量)和平均剂量(Dmean)。均匀性指数(HI)和适形性指数(CI)也用于评估PTV的剂量均匀性和适形性,并计算等剂量体积的Dice相似系数(DSC)。预测结果的剂量学参数还与标准3D UNet模型得到的结果进行了比较。
其中,PVptv表示PTV接收处方照射剂量的体积体积,DVpre和Vptv分别表示预测处方剂量体积和PTV体积。
结果
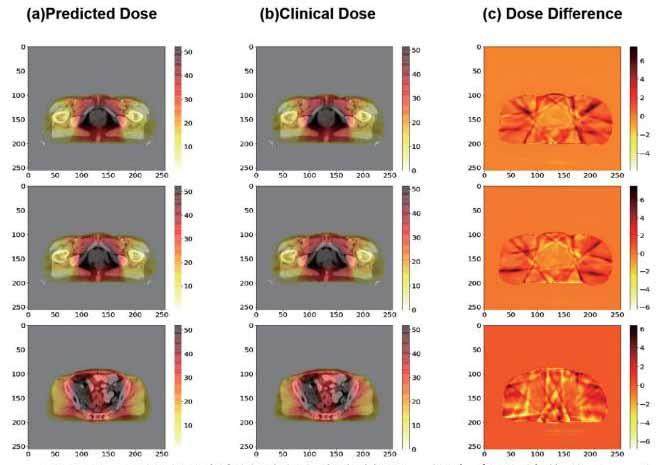
如图3所示,(a)至(c)显示了测试数据中宫颈癌病例的轴向剂量分布,分别为二维预测剂量、临床剂量和剂量分布差异图。
图3 显示了测试病例的剂量分布情况,颜色条的单位为Gy。(a)表示预测的剂量分布。(b)表示临床剂量分布。(c)表示(a)和(b)之间的剂量分布差异。
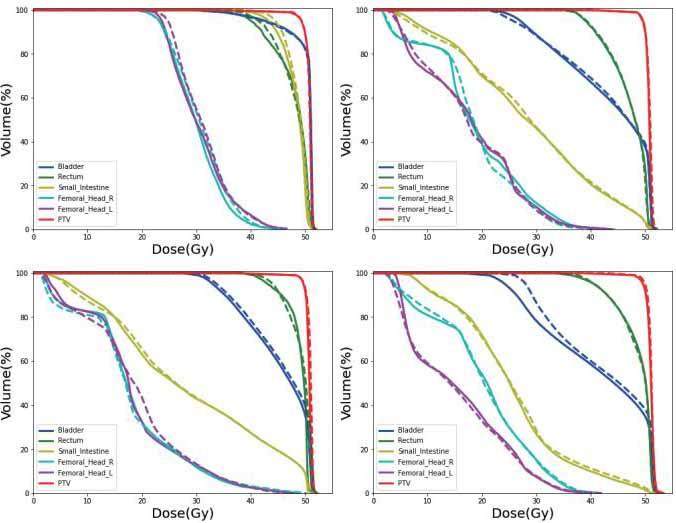
图4 展示了四个测试病例的剂量-体积直方图对比图,实线表示临床的剂量,虚线表示预测的剂量。
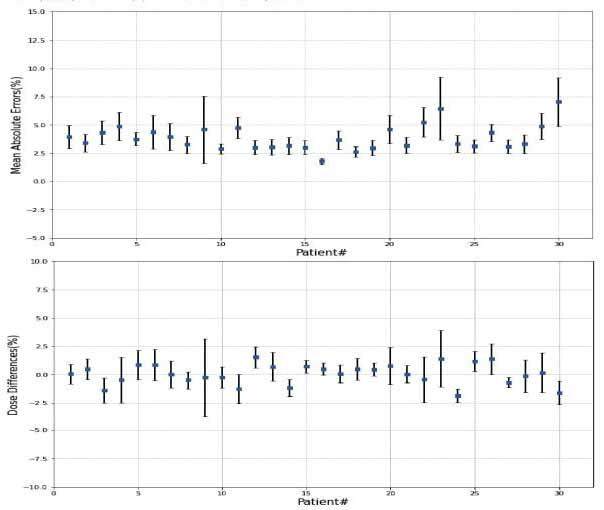
图5 展示了30个测试病例的全身体素的平均绝对误差和剂量差异。
剂量差异的统计
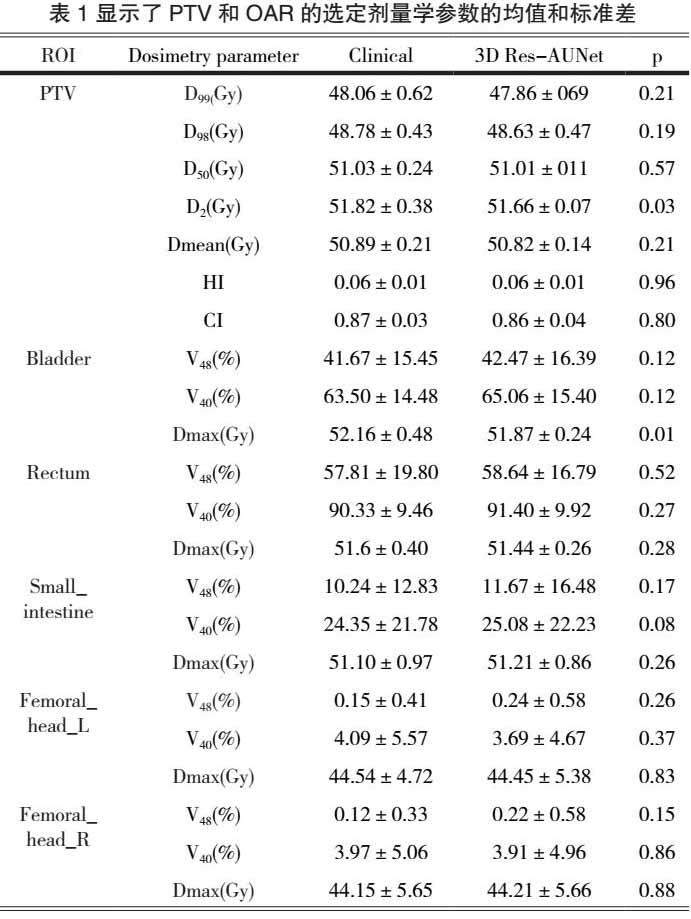
本研究计算了30名测试患者的全身体素的平均绝对误差和剂量差异,如图5所示,蓝色框表示预测偏差,误差条表示预测剂量误差。平均剂量差异范围从-1.86%到1.64%,标准差范围为0.43%到3.44%。最大的MAE为(7.04±2.14)%,最小的MAE为(1.79±0.24)%。所有测试病例的平均MAE为(3.86±1.10)%。表1总结了30名测试患者中PTV和OAR的选定剂量学参数的平均绝对差异。对于PTV,D99、D98、D50、D2和Dmean的平均绝对差异均在1.0%以内。所有选定评价指标的结果除膀胱的Dmax(P=0.01)和PTV的D2(P=0.02)与临床真实值相比无显著统计学差异(P>0.05)
讨论
开发了一种带有注意力机制和结合损失函数的3D CNN模型,用于预测宫颈癌的IMRT剂量分布。与使用二维单切片的方法不同,我们利用了包含空间解剖特征的三维矩阵作为输入。使用的均方误差(MSE)作为模型训练的损失函数。在每个epoch结束时,计算了包括体外体素在内的所有输入体素的MSE。我们提出Combined_loss用于剂量预测。这种方法可以提高模型对有效体素的利用效率。
模型在Nvidia Tesla V100卡上进行了大约12小时的训练,并且能够在几秒钟内为新输入病例预测出三维剂量图。在所有30个测试病例中,平均MAE为(3.86±1.10)%。全身体素的平均剂量差异范围为-1.86%至1.64%。除了PTV的D2和膀胱的Dmax外,临床真实值和预测值的DVH剂量学指标之间没有显著的统计学差异。尽管该模型具有准确预测宫颈癌三维剂量分布的潜力,但仍需进一步改进。PTV的D2临床平均值为(51.82±0.38) Gy,我们的预测结果为(51.07±0.07) Gy,平均比临床参数低约0.75 Gy。可能由于未能完全提取有效特征或高剂量区域的不规则性所致。
结论
在本研究中,我们开发了一个带有结合损失函数的3D Res-AUNet模型,结果表明该方法能够实现对宫颈癌IMRT计划更准确的三维剂量分布预测。准确的剂量分布图有助于严格的质量控制和自动化治疗计划。








 京公网安备 11011302003690号
京公网安备 11011302003690号


